
二、极化的类型 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化,但由于电 极表面扩散层的存在,浓差极化不可能完全消除
二、极化的类型 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化,但由于电 极表面扩散层的存在,浓差极化不可能完全消除

二、 极化的类型 例如:把两个银电极插入浓度为C的AgNO3溶液中进行电 解,阴极上反应Ag+e→Ag,根据能斯特方程: RT Ag I Ag 当电流I→0时,反应速度极慢,电极表面附近的银离子 活度与本体相同,电极电势为平衡电极电势; 当电流增大时,电极反应速度加快,阴极附近由于银 离子还原析出而活度小于本体的活度;
例如:把两个银电极插入浓度为C的AgNO3溶液中进行电 解,阴极上反应Ag++e-→Ag,根据能斯特方程: / / ln Ag Ag Ag Ag Ag RT F + + + = + $ 当电流增大时,电极反应速度加快,阴极附近由于银 离子还原析出而活度小于本体的活度; 二、极化的类型 当电流I→0时,反应速度极慢,电极表面附近的银离子 活度与本体相同,电极电势为平衡电极电势;
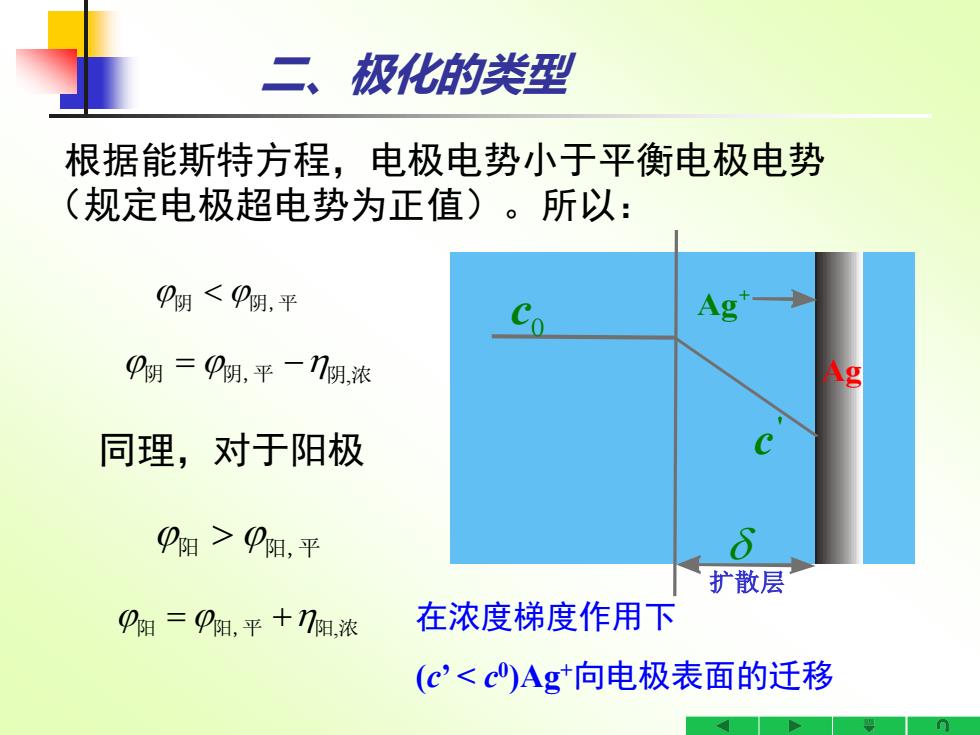
二、极化的类型 根据能斯特方程,电极电势小于平衡电极电势 (规定电极超电势为正值)。所以: P阴<P阴,平 阴=P阴,平一门阴浓 同理,对于阳极 P阳>P阳,平 扩散层 阳=阳,平+门阻,浓 在浓度梯度作用下 (c'<c)Ag*向电极表面的迁移
阴 阴,平 阴 阴,平 = − 阴 浓, 阳 = + 阳,平 阳 浓, 阳 阳,平 二、极化的类型 根据能斯特方程,电极电势小于平衡电极电势 (规定电极超电势为正值)。所以: 同理,对于阳极 在浓度梯度作用下 (c’ < c 0 )Ag+向电极表面的迁移 0 c + Ag Ag ' c 扩散层

二 极化的类型 (2)电化学极化 电极反应总是分若干步进行,若其中某一步反 应速率较慢,需要较高的活化能,为了使电极反应 顺利进行所额外施加的电压称为电化学超电势(亦 称为活化超电势),这种由于电化学超电势引起电 极的电极电势偏离平衡电极电势的现象称为电化学 极化。 电极的极化除了以上两种常见的极化外,有的电极 上由于生成氧化膜或其它物质而产生电阻引起的超 电势称为电阻超电势,电阻超电势不是普遍的
(2)电化学极化 电极反应总是分若干步进行,若其中某一步反 应速率较慢,需要较高的活化能,为了使电极反应 顺利进行所额外施加的电压称为电化学超电势(亦 称为活化超电势),这种由于电化学超电势引起电 极的电极电势偏离平衡电极电势的现象称为电化学 极化。 电极的极化除了以上两种常见的极化外,有的电极 上由于生成氧化膜或其它物质而产生电阻引起的超 电势称为电阻超电势,电阻超电势不是普遍的。 二、极化的类型

二 极化的类型 超电势与析出电势(不可逆电极电势) 在某一电流密度下,实际发生电解的电极电势不阿边 与平衡衡电极电势之间的差值称为超电势。电极超电势是 以上各种超电势之和。 7超=7浓+7电+7阻 由以上讨论可知:阳极上由于超电势使电极电势变大 阴极上由于超电势使电极电势变小。电极电势的表达式 为 门阴)=P阴,平)一P(阴,不可逆) 0阴,不可逆)=阴,平)一1阴) 门阳)=P阳,不可逆)一(阳,平) P阳,不可逆)=P阳平)+1阳)
超电势与析出电势(不可逆电极电势) 二、极化的类型 在某一电流密度下,实际发生电解的电极电势 与平衡电极电势之间的差值称为超电势。电极超电势是 以上各种超电势之和。 ( ) 不可逆 由以上讨论可知:阳极上由于超电势使电极电势变大, 阴极上由于超电势使电极电势变小。电极电势的表达式 为 超 浓 电 = + + 阻 ( ( ) ( , ) ( , ) ( , ) , ) ) ( = + 阴 不可逆 = − 阴 平 阴 阳 不 逆可 阳 平 阳 ( ) ( , ) ( ) , ( , ) ( ) ( ) , − = = 阴 阴 平 − 阳 阴 阳 不可逆 阳 平 不可逆