
ue 为什么在镧系中离子半径会出现单向变化呢? 为什么在Gd处出现一种不连续性呢? 由于镧系元素三价离子的外围电子很有规律,由La至LⅢ其 离子结构为f至f14,因此离子半径会出现“单向变化” 镧系元素三价离子半径的变化中,在Gd处出现了微小的可以 察觉的不连续性,原因是Gd+离子具有半充满的4f7电子结构, 屏蔽能力略有增加,有效核电荷略有减小,所以Gd3+离子半径的 减小要略微小些,这叫“钆断效应”. 正是由于镧系离子的电子结构,凡是与L+离子密切联系的 性质,也常呈现单向变化的规律.而且,在镧系元素化合物的有些 性质中,也常常会出现“钆断效应”,即所谓的“两分组现象
Question 1 为什么在镧系中离子半径会出现单向变化呢? 为什么在 Gd 处出现一种不连续性呢? 由于镧系元素三价离子的外围电子很有规律,由 La 至 Lu 其 离子结构为 f 0至 f 14 ,因此离子半径会出现“单向变化”. 镧系元素三价离子半径的变化中,在 Gd 处出现了微小的可以 察觉的不连续性,原因是 Gd3+离子具有半充满的 4 f 7电子结构, 屏蔽能力略有增加,有效核电荷略有减小,所以 Gd3+离子半径的 减小要略微小些,这叫 “钆断效应”. 正是由于镧系离子的电子结构,凡是与 Ln3+离子密切联系的 性质,也常呈现单向变化的规律. 而且,在镧系元素化合物的有些 性质中,也常常会出现 “钆断效应” ,即所谓的 “两分组现象
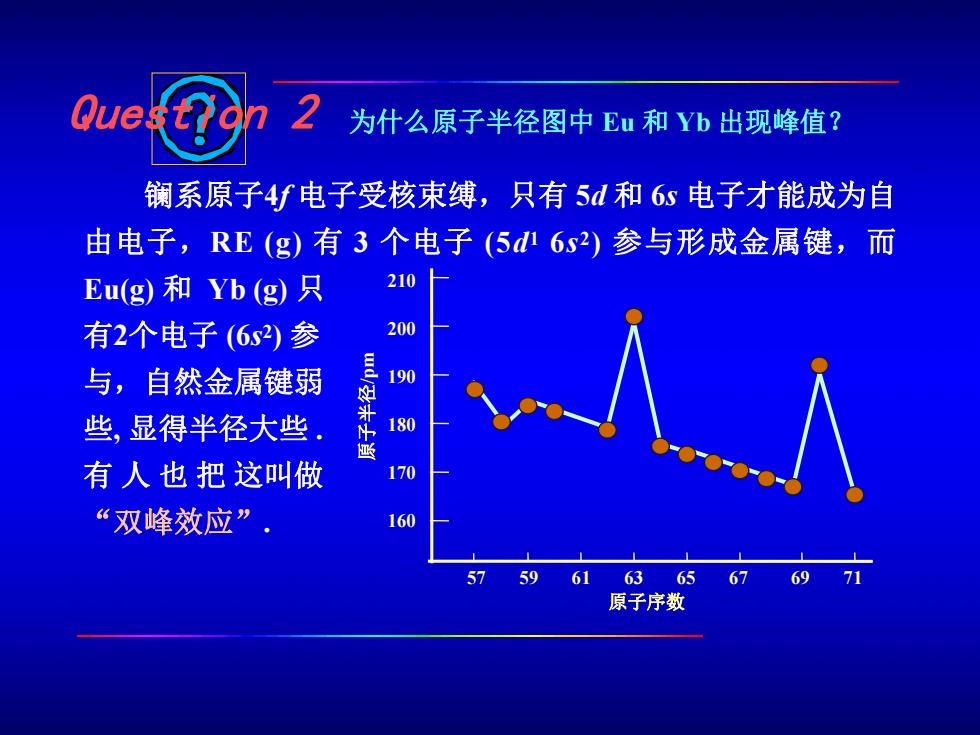
Que 为什么原子半径图中Eu和Yb出现峰值? 镧系原子4f电子受核束缚,只有5d和6s电子才能成为自 由电子,RE(g)有3个电子(5d6s2)参与形成金属键,而 Eu(g)和Yb(g)只 210 有2个电子(6s2)参 200 与,自然金属键弱 190 些,显得半径大些 180 有人也把这叫做 170 “双峰效应” 160 5961 636567 69 71 原子序数
镧系原子4f 电子受核束缚,只有 5d 和 6s 电子才能成为自 由电子,RE (g) 有 3 个电子 (5d 1 6s 2) 参与形成金属键,而 Eu(g) 和 Yb (g) 只 有2个电子 (6s 2) 参 与,自然金属键弱 些, 显得半径大些 . 有 人 也 把 这叫做 “双峰效应”. Question 2 为什么原子半径图中 Eu 和 Yb 出现峰值? 57 59 61 63 65 67 69 71 210 200 190 180 170 160 原 子 半 径/p m 原子序数

5. 离子的颜色 ●周期性十分明显 L3+离子在晶体或水溶液中的颜色 原子序离子4电子数 颜色 颜色 4电子数 离子 原子序 57 La3+ 0 无 无 14 Lu3+ 71 58 Ce3+ 无 无 13 Yb3+ 70 59 Pr3+ 2 黄绿 淡绿 12 Tm3+ 69 60 Nd3+ 3 红紫 淡红 17 Er3+ 68 61 Pm3+ 4 粉红 淡黄 10 Ho3+ 67 62 Sm3+ 5 淡黄 浅黄绿 9 Dy3+ 66 63 Eu3+ 6 浅粉红 浅粉红 8 Tb3+ 65 64 Gd3+ > 无 无 > Gd3+ 64 点ff跃迁有送 可以简单地认为离子的颜色与4f亚层中的电子跃迁有关:La3 (4f)和Lu3+(4f14离子为无色,因为不可能发生f-f跃迁;另一稳 定组态的离子Gd+(4f7)和接近稳定组态的离子Ce3+(4f),Eu+(4f6), Tb3(4f)和Yb3(4f13)的吸收峰在紫外区或红外区,因而显示无色 或浅色
5. 离子的颜色 ● 周期性十分明显 Ln3+离子在晶体或水溶液中的颜色 原子序 离子 4f电子数 颜色 颜色 4f电子数 离子 原子序 57 58 59 60 61 62 63 64 La 3+ Ce 3+ Pr 3+ Nd3+ Pm3+ Sm3+ Eu3+ Gd3+ 0 1 2 3 4 5 6 7 无 无 黄绿 红紫 粉红 淡黄 浅粉红 无 无 无 淡绿 淡红 淡黄 浅黄绿 浅粉红 无 14 13 12 11 10 9 8 7 Lu3+ Yb3+ Tm3+ Er 3+ Ho 3+ Dy 3+ Tb3+ Gd3+ 71 70 69 68 67 66 65 64 ● 与 f-f 跃迁有关 可以简单地认为离子的颜色与 4f 亚层中的电子跃迁有关:La3+ (4f 0) 和 Lu3+(4f 14) 离子为无色,因为不可能发生 f - f 跃迁;另一稳 定组态的离子 Gd3+(4f 7) 和接近稳定组态的离子Ce 3+(4f 1) ,Eu3+(4f 6) , Tb3+(4f 7) 和 Yb3+(4f 13) 的吸收峰在紫外区或红外区,因而显示无色 或浅色

13.1.2重要化合物 1. 氢氧化物和氧化物 制备●Ln+(aq+NH3·HO(或NaOH)→Ln(OH3 ● Ln(OH)3 Ln203 Pr203 Nb2O3 Er2O3 CeO2 Ln2z(C2043 D 白色 深蓝 浅蓝 粉红 淡黄 Ln2(C03)3 PrOu(4 PrO2 Pr2O3),Tb4O7(2TbO7Tb2O3) Ln(NO3)3 棕黑 暗棕 性质●氧化物属碱性氧化物,不溶于碱而溶于酸;高温灼烧过的 CeO,难溶于强酸,需要加入还原剂如以助溶; 氧化物是一种盐转化为另一种盐的重要中间体; 许多氧化物有重要的用途:L2O3用于制造光学玻璃, CeO2是抛光粉,Eu203用于制造彩色荧光粉等
13.1.2 重要化合物 1. 氢氧化物和氧化物 制备 ● Ln3+ (aq) + NH3 · H2O (或 NaOH) → Ln (OH)3↓ Ln2O3 Pr2O3 Nb2O3 Er2O3 CeO2 白色 深蓝 浅蓝 粉红 淡黄 Pr6O11(4 PrO2• Pr2O3 ), Tb4O7(2TbO7 •Tb2O3) 棕黑 暗棕 ● Ln (OH)3 Ln2(C2O4)3 Ln2(CO3)3 Ln (NO3)3 D 性质 ● 氧化物属碱性氧化物,不溶于碱而溶于酸;高温灼烧过的 CeO2难溶于强酸,需要加入还原剂如以助溶; ● 氧化物是一种盐转化为另一种盐的重要中间体; ● 许多氧化物有重要的用途: Ln2O3 用于制造光学玻璃, CeO2 是抛光粉, Eu2O3 用于制造彩色荧光粉等
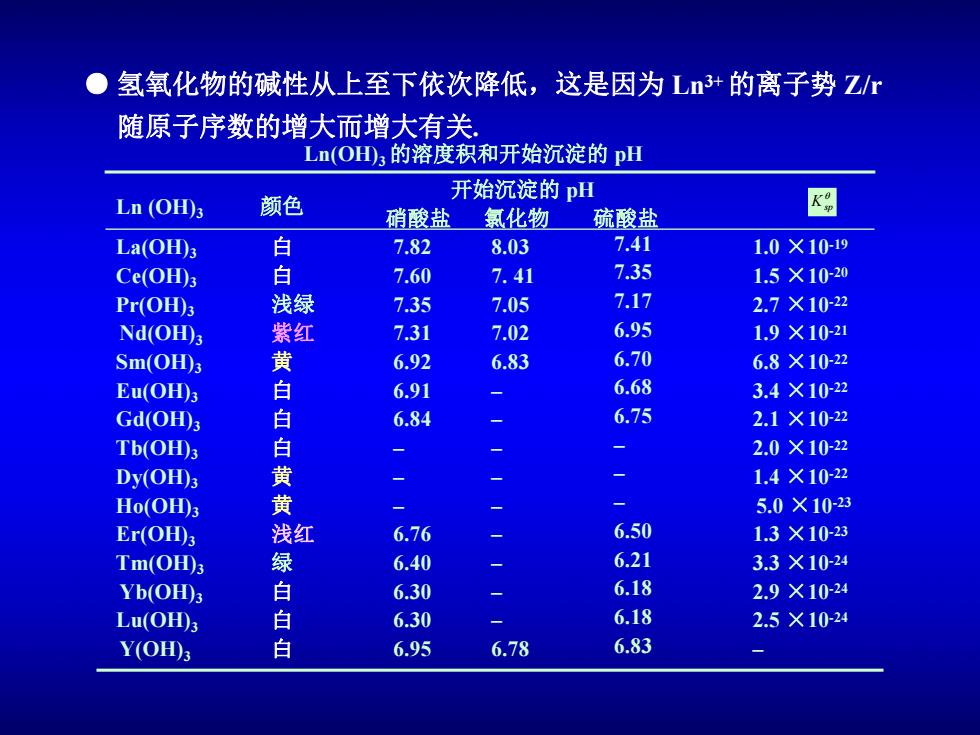
● 氢氧化物的碱性从上至下依次降低,这是因为L+的离子势Z 随原子序数的增大而增大有关, Ln(O山3的溶度积和开始沉淀的pH 开始沉淀的pH Ln (OH)3 颜色 硝酸盐氯化物硫酸盐 K La(OH)3 白 7.82 8.03 7.41 1.0×10-19 Ce(OH)3 白 7.60 7.41 7.35 1.5×10-20 Pr(OH)3 浅绿 7.35 7.05 7.17 2.7×10-22 Nd(OH)s 紫红 7.31 7.02 6.95 1.9×10-21 Sm(OH)3 黄 6.92 6.83 6.70 6.8×10-22 Eu(OH)3 白 6.91 6.68 3.4×10-22 Gd(OH) 白 6.84 6.75 2.1×10-22 Tb(OH)3 白 2.0×10-22 Dy(OH)3 黄 1.4×10-22 Ho(OH)3 黄 5.0×10-23 Er(OH)3 浅红 6.76 6.50 1.3×10-23 Tm(OH)3 绿 6.40 6.21 3.3×10-24 Yb(OH)3 白 6.30 6.18 2.9×10-24 Lu(OH)3 白 6.30 6.18 2.5×10-24 Y(OH); 白 6.95 6.78 6.83
白 白 浅绿 紫红 黄 白 白 白 黄 黄 浅红 绿 白 白 白 Ln(OH)3的溶度积和开始沉淀的 pH La(OH)3 Ce(OH)3 Pr(OH)3 Nd(OH)3 Sm(OH)3 Eu(OH)3 Gd(OH)3 Tb(OH)3 Dy(OH)3 Ho(OH)3 Er(OH)3 Tm(OH)3 Yb(OH)3 Lu(OH)3 Y(OH)3 开始沉淀的 pH 硝酸盐 氯化物 硫酸盐 Ln (OH)3 颜色 q Ksp 7.82 7.60 7.35 7.31 6.92 6.91 6.84 – – – 6.76 6.40 6.30 6.30 6.95 8.03 7. 41 7.05 7.02 6.83 – – – – – – – – – 6.78 7.41 7.35 7.17 6.95 6.70 6.68 6.75 – – – 6.50 6.21 6.18 6.18 6.83 1.0 ×10 -19 1.5 ×10 -20 2.7 ×10 -22 1.9 ×10 -21 6.8 ×10 -22 3.4 ×10 -22 2.1 ×10 -22 2.0 ×10 -22 1.4 ×10 -22 5.0 ×10 -23 1.3 ×10 -23 3.3 ×10 -24 2.9 ×10 -24 2.5 ×10 -24 – ● 氢氧化物的碱性从上至下依次降低,这是因为 Ln3+的离子势 Z/r 随原子序数的增大而增大有关