
第四章:沉淀反应 12-15分值 1考试内容:溶度积规则及有关计算:稀释效应、同离子效应、盐效应及对弱电解质的电离 平衡的影响:溶度积Kp·溶度积规则。 2.考试要求:能进行溶度积与溶解度相互运算,能进行沉淀反应的相关计算。 了解:分步沉淀及转化。 第五章:氧化还原反应15-18分值 1.考试内容:氧化还原方程式配平,原电池的表达方式,电极电势及其影响因素,判断氧化 还原性的强弱,判断氧化还原反应的方向及平衡常数的计算,Nernst方程的应用,元素电势 图的应用。 2.考试要求:原电池的写法,能判断标准态下和非标淮状态下氧化还原反应的方向,已经进 行氧化还原反应的方向的判定及平衡常数的计算。 第六章:原子结构和元素周期性12-15分值 1考试内容:原子核外电子的排布规律,电子排布式和轨道式的书写,量子数概念及取值规 则,元素性质的周期性与原子结构的关系。 2.考试要求:能进行电子排布式和轨道式的书写,能根据元素的电子组态确定它在元素周期 表中的位置,元素性质的周期性变化规律。 第七章:共价键与分子的结构10-15分值 1.考试内容:共价键的特征,杂化轨道理论,常见分子的构型,分子间力(取向力、诱导力 色散力)和氧键。 2考试要求:能用杂化轨道理论判定常见分子构型,能判定分子间力及氢键,以及对物理性 质的影响。 第八章:配位化合物 10-15分值 1考试内容:配位化合物的基本概念,配合物的组成和命名方法,配合物分子构型的判定, 配位平衡移动的主要因素及相关计算 2.考试要求:能进行配合物的命名及书写,常见配合物分子构型,以及配位平衡的相关计 算。 第九章:主族元素 不作为考试内容 第十章:过渡元素(1) 12
12 第四章:沉淀反应 12-15 分值 1.考试内容:溶度积规则及有关计算;稀释效应、同离子效应、盐效应及对弱电解质的电离 平衡的影响;溶度积 Ksp,溶度积规则。 2.考试要求:能进行溶度积与溶解度相互运算,能进行沉淀反应的相关计算。 了解:分步沉淀及转化。 第五章:氧化还原反应 15-18 分值 1.考试内容:氧化还原方程式配平,原电池的表达方式,电极电势及其影响因素,判断氧化 还原性的强弱,判断氧化还原反应的方向及平衡常数的计算,Nernst 方程的应用,元素电势 图的应用。 2.考试要求:原电池的写法,能判断标准态下和非标准状态下氧化还原反应的方向,已经进 行氧化还原反应的方向的判定及平衡常数的计算。 第六章:原子结构和元素周期性 12-15 分值 1.考试内容:原子核外电子的排布规律,电子排布式和轨道式的书写,量子数概念及取值规 则,元素性质的周期性与原子结构的关系。 2.考试要求:能进行电子排布式和轨道式的书写,能根据元素的电子组态确定它在元素周期 表中的位置,元素性质的周期性变化规律。 第七章:共价键与分子的结构 10-15 分值 1.考试内容:共价键的特征,杂化轨道理论,常见分子的构型,分子间力(取向力、诱导力、 色散力)和氢键。 2.考试要求:能用杂化轨道理论判定常见分子构型,能判定分子间力及氢键,以及对物理性 质的影响。 第八章:配位化合物 10-15 分值 1.考试内容:配位化合物的基本概念,配合物的组成和命名方法,配合物分子构型的判定, 配位平衡移动的主要因素及相关计算 2.考试要求:能进行配合物的命名及书写,常见配合物分子构型,以及配位平衡的相关计 算。 第九章:主族元素 不作为考试内容 第十章:过渡元素(1)

不作为考试内容 第十一章:过渡元素(2) 不作为考试内容 第十二章:镧系与锕系元素 不作为考试内容 第十三章:核化学与放射化学简介 不作为考试内容 第十四章:无机化学与生态环境 不作为考试内容 五、考试方式及时间 闭卷:100分钟 六、考试题型结构及分值分布: 选择题:25-30%: 判断题:10-15% 填空题:20-30% 简答题:10-15% 计算题:25~35% 七、成绩综合评定方法: 学生最后总成绩由平时成绩30%平时成绩(到课率10%+课堂表现10%+课后作业10%) +70%考试成绩的总和确定。 八、教材及主要参考书: 1、选用教材: 《无机化学》第二版,周德风、袁亚莉主编,华中科技大学出版社,2014年 2、主要参考书: 《无机化学》袁亚莉、周德风主编,华中科技大学出版社,2007年 《无机化学》第二版,谢吉民主编,人民卫生出版社,2013年 执笔人:王平系室审核人:肖锡林 13
13 不作为考试内容 第十一章:过渡元素(2) 不作为考试内容 第十二章:镧系与锕系元素 不作为考试内容 第十三章:核化学与放射化学简介 不作为考试内容 第十四章:无机化学与生态环境 不作为考试内容 五、考试方式及时间 闭卷;100 分钟 六、考试题型结构及分值分布: 选择题:25~30%; 判断题:10~15%; 填空题:20~30% 简答题:10~15% 计算题:25~35% 七、成绩综合评定方法: 学生最后总成绩由平时成绩 30% 平时成绩(到课率 10% + 课堂表现 10% +课后作业 10%) + 70% 考试成绩的总和确定。 八、教材及主要参考书: 1、选用教材: 《无机化学》第二版,周德凤、袁亚莉主编,华中科技大学出版社,2014 年 2、主要参考书: 《无机化学》袁亚莉、周德凤主编,华中科技大学出版社,2007 年 《无机化学》第二版,谢吉民主编,人民卫生出版社,2013 年 执笔人:王平 系室审核人:肖锡林

《无机化学实验C》教学大纲 Inorganic Chemical Experiments C 课程编号130805028 课程类别独立开设实验课程 学时 16 学分0.5 适用对象环境,环保,给排水 先修课程《无机化学》 一、课程的性质与任务 该课程可以支撑毕业要求第1、2、4、5、8、9条的达成。 《无机化学实验C》的任务是:(1)使学生巩固和加深对无机化学基本理论和基本知识的 理解和认识:(2)使学生能掌握一些必要的无机化学实验技术和方法,具备一定的无机化学实 验技能:(3)使学生通过无机化学实验的学习,熟悉元素和化合的性质及变化的规律,掌握无 机化合的分离、纯化和制备的一些方法,为后继实验课程的学习及今后的实际工作打下坚实的 基础 二、教学的目的与要求 本课程主要目的和要求是使学生掌握和了解元素及其化合物的性质:掌握和了解无机化合 物的分离、纯化及制备方法:掌握最基本的无机化学实验技术:熟悉和掌握实验数据的处理及 实验结果的分析与归钠的方法,加深对无机化学基本理论和基本概念的理解:提高学生科学研 究和解决实际问题的能力:培养学生严谨的科学态度。 三、考核方式及办法 考核方式:考查 考核办法:全部实验项目成绩的平均值。 四、实验项目名称与学时分配 《无机化学实验C》课程安排一览表 学时 分组 序号 实验项目名称 实验 分配 必开或选开 类型 人数 】酸碱溶液的配制、标定及浓度的比较 4 必开 综合 2称量仪器的使用(台平、天平称量练习) 4 选开 验证 1 14
14 《无机化学实验 C》教学大纲 Inorganic Chemical Experiments C 课程编号 130805028 课程类别 独立开设实验课程 学 时 16 学 分 0.5 适用对象 环境,环保,给排水 先修课程 《无机化学》 一、课程的性质与任务 该课程可以支撑毕业要求第 1、2、4、5、8、9 条的达成。 《无机化学实验 C》的任务是:(1)使学生巩固和加深对无机化学基本理论和基本知识的 理解和认识;(2)使学生能掌握一些必要的无机化学实验技术和方法,具备一定的无机化学实 验技能;(3)使学生通过无机化学实验的学习,熟悉元素和化合的性质及变化的规律,掌握无 机化合的分离、纯化和制备的一些方法,为后继实验课程的学习及今后的实际工作打下坚实的 基础。 二、教学的目的与要求 本课程主要目的和要求是使学生掌握和了解元素及其化合物的性质;掌握和了解无机化合 物的分离、纯化及制备方法;掌握最基本的无机化学实验技术;熟悉和掌握实验数据的处理及 实验结果的分析与归纳的方法,加深对无机化学基本理论和基本概念的理解;提高学生科学研 究和解决实际问题的能力;培养学生严谨的科学态度。 三、考核方式及办法 考核方式:考查 考核办法:全部实验项目成绩的平均值。 四、实验项目名称与学时分配 《无机化学实验 C》课程安排一览表 序号 实验项目名称 学时 分配 必开或选开 实验 类型 分组 人数 1 酸碱溶液的配制、标定及浓度的比较 4 必开 综合 1 2 称量仪器的使用(台平、天平称量练习) 4 选开 验证 1
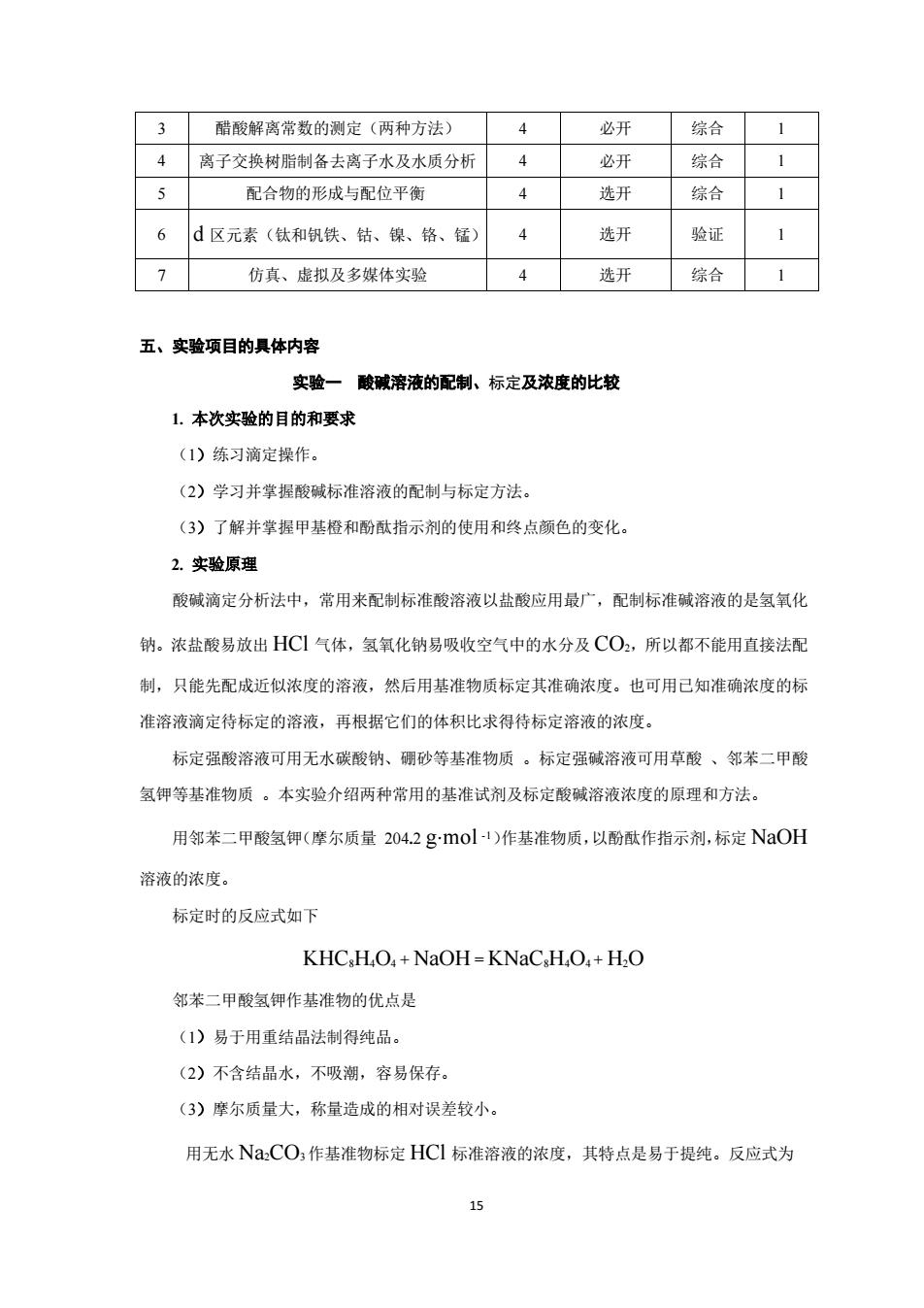
3 醋酸解离常数的测定(两种方法) 4 必开 综合 4 离子交换树脂制备去离子水及水质分材 4 必开 综合 5 配合物的形成与配位平衡 4 选开 综合 6d区元素(钛和钒铁、钻、镍、铬、锰) 选开 验证 7 仿真、虚拟及多媒体实验 4 选开 综合 五、实验项目的具体内容 实验一酸碱溶液的配制、标定及浓度的比较 1.本次实验的目的和要求 (1)练习滴定操作。 (2)学习并掌握酸碱标准溶液的配制与标定方法。 (3)了解并掌握甲基橙和酚酞指示剂的使用和终点颜色的变化, 2.实验原理 酸碱滴定分析法中,常用来配制标准酸溶液以盐酸应用最广,配制标准碱溶液的是氢氧化 钠。浓盐酸易放出HC1气体,氢氧化钠易吸收空气中的水分及CO2,所以都不能用直接法配 制,只能先配成近似浓度的溶液,然后用基准物质标定其准确浓度。也可用已知准确浓度的标 准溶液滴定待标定的溶液,再根据它们的体积比求得待标定溶液的浓度。 标定强酸溶液可用无水碳酸钠、硼砂等基准物质。标定强碱溶液可用草酸、邻苯二甲酸 氢钾等基准物质。本实验介绍两种常用的基准试剂及标定酸碱溶液浓度的原理和方法。 用邻苯二甲酸氢钾(摩尔质量204.2gmol)作基准物质,以酚酞作指示剂,标定NOH 溶液的浓度。 标定时的反应式如下 KHC,HO,+NaOH=KNaC,H,O,+H.O 邻苯二甲酸氢钾作基准物的优点是 (1)易于用重结晶法制得纯品。 (2)不含结品水,不吸潮,容易保存。 (3)摩尔质量大,称量造成的相对误差较小。 用无水N,CO,作基准物标定HCI标准溶液的浓度,其特点是易于提纯。反应式为 15
15 3 醋酸解离常数的测定(两种方法) 4 必开 综合 1 4 离子交换树脂制备去离子水及水质分析 4 必开 综合 1 5 配合物的形成与配位平衡 4 选开 综合 1 6 d 区元素(钛和钒铁、钴、镍、铬、锰) 4 选开 验证 1 7 仿真、虚拟及多媒体实验 4 选开 综合 1 五、实验项目的具体内容 实验一 酸碱溶液的配制、标定及浓度的比较 1. 本次实验的目的和要求 (1)练习滴定操作。 (2)学习并掌握酸碱标准溶液的配制与标定方法。 (3)了解并掌握甲基橙和酚酞指示剂的使用和终点颜色的变化。 2. 实验原理 酸碱滴定分析法中,常用来配制标准酸溶液以盐酸应用最广,配制标准碱溶液的是氢氧化 钠。浓盐酸易放出 HCl 气体,氢氧化钠易吸收空气中的水分及 CO2,所以都不能用直接法配 制,只能先配成近似浓度的溶液,然后用基准物质标定其准确浓度。也可用已知准确浓度的标 准溶液滴定待标定的溶液,再根据它们的体积比求得待标定溶液的浓度。 标定强酸溶液可用无水碳酸钠、硼砂等基准物质 。标定强碱溶液可用草酸 、邻苯二甲酸 氢钾等基准物质 。本实验介绍两种常用的基准试剂及标定酸碱溶液浓度的原理和方法。 用邻苯二甲酸氢钾(摩尔质量 204.2 g·mol -1)作基准物质,以酚酞作指示剂,标定 NaOH 溶液的浓度。 标定时的反应式如下 KHC8H4O4 + NaOH = KNaC8H4O4 + H2O 邻苯二甲酸氢钾作基准物的优点是 (1)易于用重结晶法制得纯品。 (2)不含结晶水,不吸潮,容易保存。 (3)摩尔质量大,称量造成的相对误差较小。 用无水 Na2CO3 作基准物标定 HCl 标准溶液的浓度,其特点是易于提纯。反应式为

NaCO:+2HCI=2NaCl+H2O+CO2 由于NaCO易吸收空气中的水分,因此,采用市售基准试剂级的NaCO时,应预先 于180℃~200℃使之充分干燥,然后密封于瓶内,保存于干燥器中备用。标定时常用甲基橙作 指示剂。 NOH标准溶液和HCI标准溶液的浓度,一般只需标定其中一种,另一种则通过两种溶 液滴定的体积比算出。标定哪种溶液,要视采用何种标准溶液测定何种试样而定。原则上应标 定测定时所用的标准溶液,并使标定条件与测定条件尽可能一致。 3.需用的仪器、试剂及材料 仪器分析天平:酸式滴定管:碱式滴定管:滴定台:锥形瓶:洗瓶:电炉。 试剂NaOH(固体):HCI(浓):甲基橙(0.1%):酚酞(0.1%酚酞和50%CH,OH 溶液):邻苯二甲酸氢钾(A.R,用前在烘箱内105℃烘干h,取出后置干燥器内保存):无 水NaCO3(G.R,于180℃~200℃烘干1h)。 4.实验步骤 4.10.1 mol-L-NaOH标准溶液的配制与标定 (1)0.1mo-L-NaOH标淮溶液的配制 (2)0.1mol-L-NaOH标准溶液的标定 4.20.1 mol-L-HCI标准溶液的配制与标定 (1)0.1 mol.L-HCI标准溶液的配制 (2)0.1 mol-L-HC1标准溶液的标定 按上述方法再重复滴定2次。计算HC溶液的浓度。取平均值。计算绝对偏差和相对平 均偏差。 43数据记录与处理 5.教学方式 (1)开放性实验教学。 (2)实验前学生要写好预习报告: 16
16 Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑ 由于 Na2CO3 易吸收空气中的水分,因此,采用市售基准试剂级的 Na2CO3时,应预先 于 180℃~200℃使之充分干燥,然后密封于瓶内,保存于干燥器中备用。标定时常用甲基橙作 指示剂。 NaOH 标准溶液和 HCl 标准溶液的浓度,一般只需标定其中一种,另一种则通过两种溶 液滴定的体积比算出。标定哪种溶液,要视采用何种标准溶液测定何种试样而定。原则上应标 定测定时所用的标准溶液,并使标定条件与测定条件尽可能一致。 3. 需用的仪器、试剂及材料 仪器 分析天平;酸式滴定管;碱式滴定管;滴定台;锥形瓶;洗瓶;电炉。 试剂 NaOH(固体);HCl(浓);甲基橙(0.1%);酚酞(0.1%酚酞和 50%C2H5OH 溶液);邻苯二甲酸氢钾(A.R.,用前在烘箱内 105℃烘干 1h,取出后置干燥器内保存);无 水 Na2CO3(G.R.,于 180℃~200℃烘干 1h)。 4. 实验步骤 4.1 0.1 mol·L-1NaOH 标准溶液的配制与标定 (1)0.1 mol·L-1NaOH 标准溶液的配制 (2)0.1 mol·L-1NaOH 标准溶液的标定 4.2 0.1 mol·L-1HCl 标准溶液的配制与标定 (1)0.1 mol·L-1HCl 标准溶液的配制 (2)0.1 mol·L-1HCl 标准溶液的标定 按上述方法再重复滴定 2 次。计算 HCl 溶液的浓度。取平均值。计算绝对偏差和相对平 均偏差。 4.3 数据记录与处理 5. 教学方式 (1)开放性实验教学; (2)实验前学生要写好预习报告;