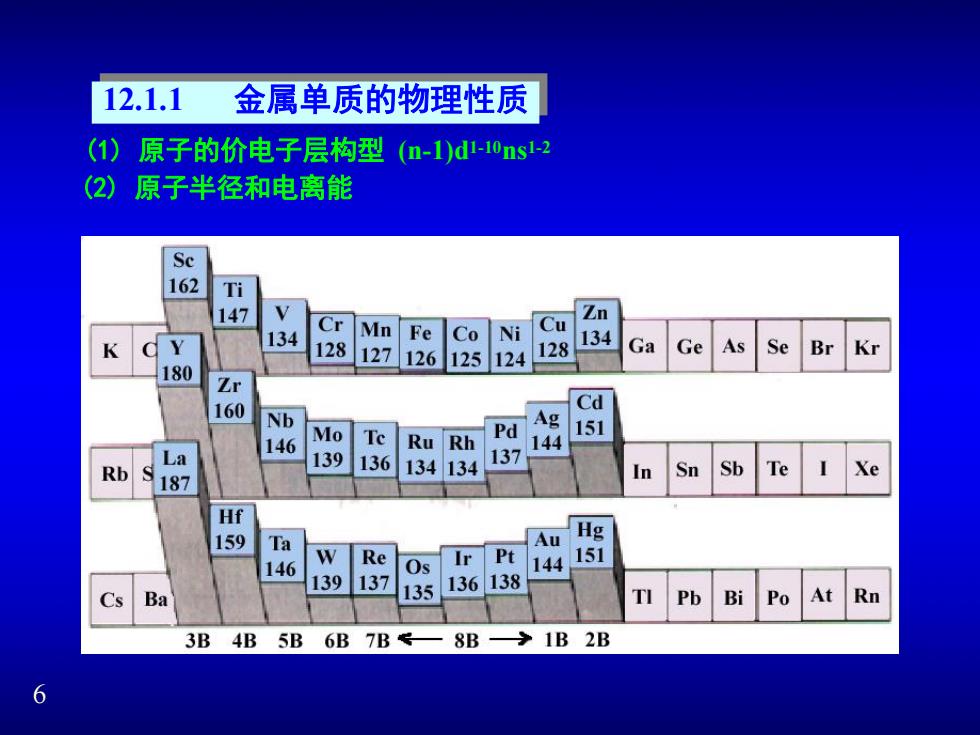
12.1.1 金属单质的物理性质 (1)原子的价电子层构型(m-1)d-10ns-2 (2)原子半径和电离能 Se 162 Ti 147 Zn Cr 134 Mn Fe Co Ni Cu 128 127 128 134 Ga Ge As Se 126 125124 Br Kr 180 Zr 160 Cd Nb Ag Pd 151 146 Mo Te Ru Rh 144 La 139 136 137 Rb 134134 Sn Sb Te Xe 187 In Hf 159 Ta Au Hg W Re Os Ir Pt 151 146 144 139 137 136138 Cs Ba 135 Pb Bi Po At Rn 3B 4B 5B 6B 7B8B>1B 2B 6
6 12.1.1 金属单质的物理性质 (2) 原子半径和电离能 (1) 原子的价电子层构型 (n-1)d1-10ns 1-2
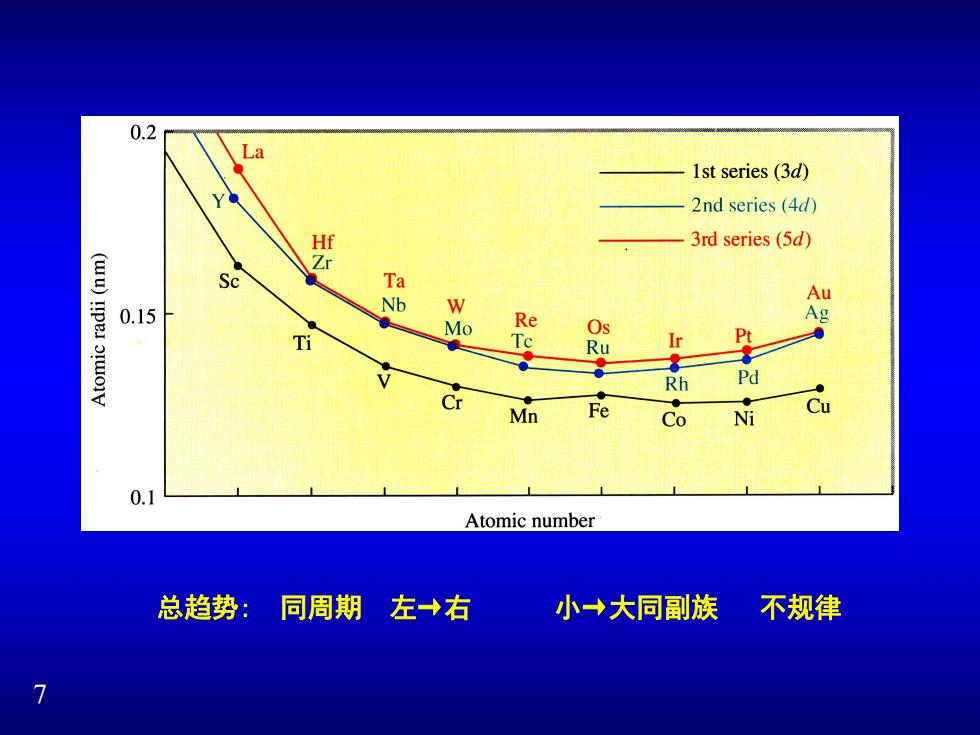
0.2 La 1st series(3d) Y 2nd series (4d) 红 3rd series(5d) Zr Sc 】 Ta Au 0.15 Mo Re Ag Os Ti Tc Pt Ru Ir RH Pd Mn Fe Cu Co Ni 0.1 Atomic number 总趋势:同周期 左→右 小→大同副族 不规律
7 总趋势: 同周期 左→右 小→大同副族 不规律

(3)金属单质的物理性质 ●熔点、沸点高 Se Cr Mn Fe Co Ni a Nb Mo Ge As Se Br Kr 熔点最高的单质: Pd 钨W)3683±20℃ Rb Sr a Re Sn Sb Te I Xe Hg TI Pb Bi Po At Rn 3B 4B 5B 6B 7B 8B 1B 2B ●硬度大 硬度最大的金属:铬(Cr)摩氏9.0 ●密度大 Cr Fe Co Ni Cu Zn K Ca Se Ti Ga Ge As Se Br Kr Rh 密度最大的单质: d 锇(0s)22.48gcm-3 Rb Sr In Sn Sb Te I xe Cs Ba TI Pb Bi Po At Rn 3B 4B 5B6B7B—8B>1B2B ●导电性,导热性,延展性好 8
8 (3) 金属单质的物理性质 ●硬度大 硬度最大的金属:铬(Cr) 摩氏 9.0 ●导电性,导热性,延展性好 ●熔点、沸点高 熔点最高的单质: 钨(W) 3683±20℃ ●密度大 密度最大的单质: 锇(Os ) 22.48 g·cm-3

(4 金属元素的原子化焓 Sc Ti Cr Mn Fe Co Ni Cu Zn 381 470 515 397 285 415 423 422 339 131 Y Zr Nb Mo Te Ru Rh Pd Ag Cd 420 593 752 659 661 650 558 373 285 112 a Hf Ta W Re Os Ir Pt Au 431 789 782 851 778 790 669 565 368 6 金属元素的原子化焓是金属内部原子结合力强弱的一种标志,较高 的原子化焓可能是由于较多的价电子(特别是较多的未成对电子)参与 形成金属键,这种结合力似乎也应该反映在过渡元素的上述物理性质上 9
9 (4) 金属元素的原子化焓 金属元素的原子化焓是金属内部原子结合力强弱的一种标志,较高 的原子化焓可能是由于较多的价电子(特别是较多的未成对电子)参与 形成金属键.这种结合力似乎也应该反映在过渡元素的上述物理性质上. 381 470 515 397 285 415 423 422 339 131 420 593 752 659 661 650 558 373 285 112 431 789 782 851 778 790 669 565 368 61

随周期数的增加,为什么s区元素化学 活性增加,而d区元素却化学活性减弱? 金属元素化学活性的大小,并非全由电离能定量给出.因为电 离能只能反映处于气态金属原子失去电子的难易.例如,比较一价 金属与酸溶液反应的难易,则与下列循环有关: △H M(s) M+(aq)+e △H △H △H △H=△H1+△H1+△H M(g) M+(g) e- s区元素从上到下总热效应△H(吸热)总的来说是变小的,这就 表明它们在水溶液中变成水合离子的倾向从上到下变大,而d区元 素从上到下总热效应△H(吸热)增大,因此它们的活性都变小, 如果反应不在溶液中进行,则应该比较金属的升华热,电离 能和相应的晶格能。通过相似的计算也可得到与上面相同的结论。 10
10 Question 1 随周期数的增加,为什么 s 区元素化学 活性增加,而 d 区元素却化学活性减弱? 金属元素化学活性的大小,并非全由电离能定量给出. 因为电 离能只能反映处于气态金属原子失去电子的难易. 例如,比较一价 金属与酸溶液反应的难易,则与下列循环有关: M(s) M+(aq) + e – △H M(g) M+(g) + e – △H1 △HI △Hh △H=△HI + △H1 + △Hh s 区元素从上到下总热效应 △H (吸热)总的来说是变小的,这就 表明它们在水溶液中变成水合离子的倾向从上到下变大,而 d 区元 素从上到下总热效应 △H (吸热)增大,因此它们的活性都变小. 如果反应不在溶液中进行,则应该比较金属的升华热,电离 能和相应的晶格能. 通过相似的计算也可得到与上面相同的结论