
内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 d轨道,m=-2,-1,0,+1,+2有五个伸展方向 图5.6原子轨道伸展方向 (4④)自旋量子数m 用波函数ym描述原子中电子的运动,习惯上称为轨道运动,它由n,1,m三个 量子数所规定,电子还有自旋运动(虽然从量子力学的观点来看,电子并不存在像地球 那样绕自身轴而旋转的经典的自旋概念),因而产生磁矩,电子自旋磁矩只有两个方向。 因此,自旋量子数的取值仅有两个,分别为+1/2和-1/2,也常形象地表示为个和↓。 两个电子处于不同的所谓自旋状态叫做自旋反平行,可用符号“个”或“”表示:处 于相同的所谓自旋状态叫做自旋平行,可以用符号“↑个”或“小”表示。即一个轨道中的电 可以有两种不同的自旋方向 自旋 平 旋平 表5.1氢原子轨道与三个量子数的关系 轨道名称轨道数 0 0 0 2s 2 34 1 0,±1 2p 0 35 y 0,±1 弘 3 2 0,±1,±2 0 0 45 1 0,±1 0,±1,±2 0,±1,±2,±3 7 5.12、电子云 基态氢原子核外电子的运动 假定我们能用高速照相机摄取一个电子在某一瞬间的空间位置,然后对在不同瞬间 拍摄的千百万张照片上电子的位置进行考察,则会发现明显的统计性规律。即:电子经 常出现的区域是一个球形空间。叠加图形被形象地称为电子云。电子云是空间某单位体 积内找到电子的概率分布的图形,故也称为概率密度 图5.8电子云的统计概念(二维投影) a)单张照片:b)二张照片c)大量照片 ,就是P,即单位体积中的几率
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 6 d 轨道, m=-2,-1,0,+1,+2 有五个伸展方向 图 5.6 原子轨道伸展方向 (4) 自旋量子数ms 用波函数 n,l,m 描述原子中电子的运动,习惯上称为轨道运动,它由 n , l , m 三个 量子数所规定,电子还有自旋运动(虽然从量子力学的观点来看,电子并不存在像地球 那样绕自身轴而旋转的经典的自旋概念),因而产生磁矩,电子自旋磁矩只有两个方向。 因此,自旋量子数的取值仅有两个,分别为+1/2 和-1/2,也常形象地表示为 和 。 两个电子处于不同的所谓自旋状态叫做自旋反平行,可用符号“↑↓”或“↓↑”表示;处 于相同的所谓自旋状态叫做自旋平行,可以用符号“↑↑”或“↓↓”表示。即一个轨道中的电 子可以有两种不同的自旋方向:自旋反平行;自旋平行。 表 5.1 氢原子轨道与三个量子数的关系 5.1.2、 电子云 基态氢原子核外电子的运动 假定我们能用高速照相机摄取一个电子在某一瞬间的空间位置,然后对在不同瞬间 拍摄的千百万张照片上电子的位置进行考察,则会发现明显的统计性规律。即:电子经 常出现的区域是一个球形空间。叠加图形被形象地称为电子云。电子云是空间某单位体 积内找到电子的概率分布的图形,故也称为概率密度。 图 5.8 电子云的统计概念(二维投影) a) 单张照片;b) 二张照片 c)大量照片 2 i 就是ρ,即单位体积中的几率。 y x b y x b y x a
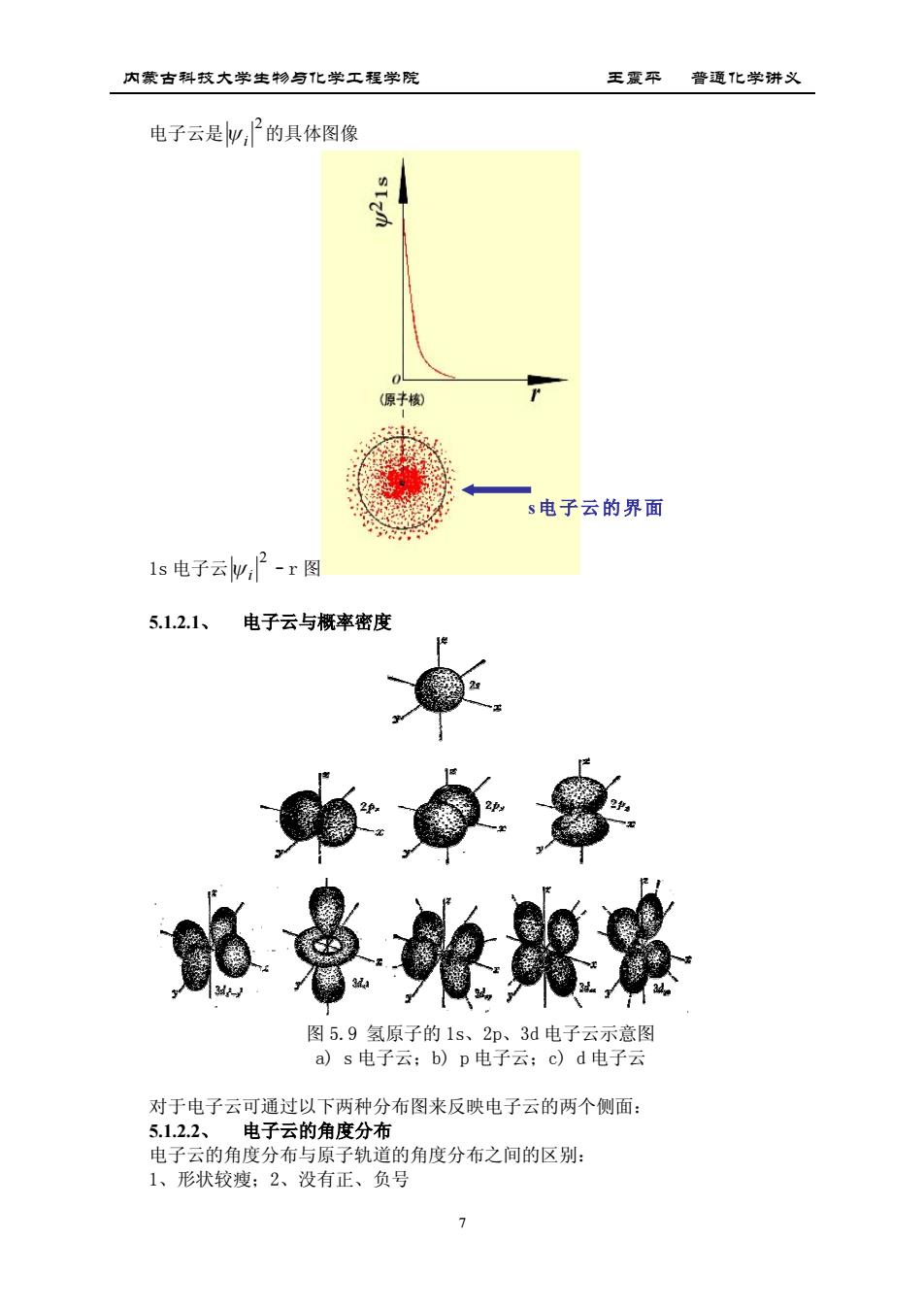
内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 电子云是妙,2的具体图像 s电子云的界面 1s电子云w,2-r图 5.1.2.1、 电子云与概率密度 0每8 略典鞭朗是 图5.9氢原子的1s、2p、3d电子云示意图 a)s电子云:b)p电子云:c)d电子云 对于电子云可通过以下两种分布图来反映电子云的两个侧面: 5.12.2、电子云的角度分布 电子云的角度分布与原子轨道的角度分布之间的区别: 1、形状较瘦:2、没有正、负号 >
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 7 电子云是 2 i 的具体图像 1s 电子云 2 i –r 图 5.1.2.1、 电子云与概率密度 图 5.9 氢原子的 1s、2p、3d 电子云示意图 a) s 电子云;b) p 电子云;c) d 电子云 对于电子云可通过以下两种分布图来反映电子云的两个侧面: 5.1.2.2、 电子云的角度分布 电子云的角度分布与原子轨道的角度分布之间的区别: 1、形状较瘦;2、没有正、负号 s电子云的界面
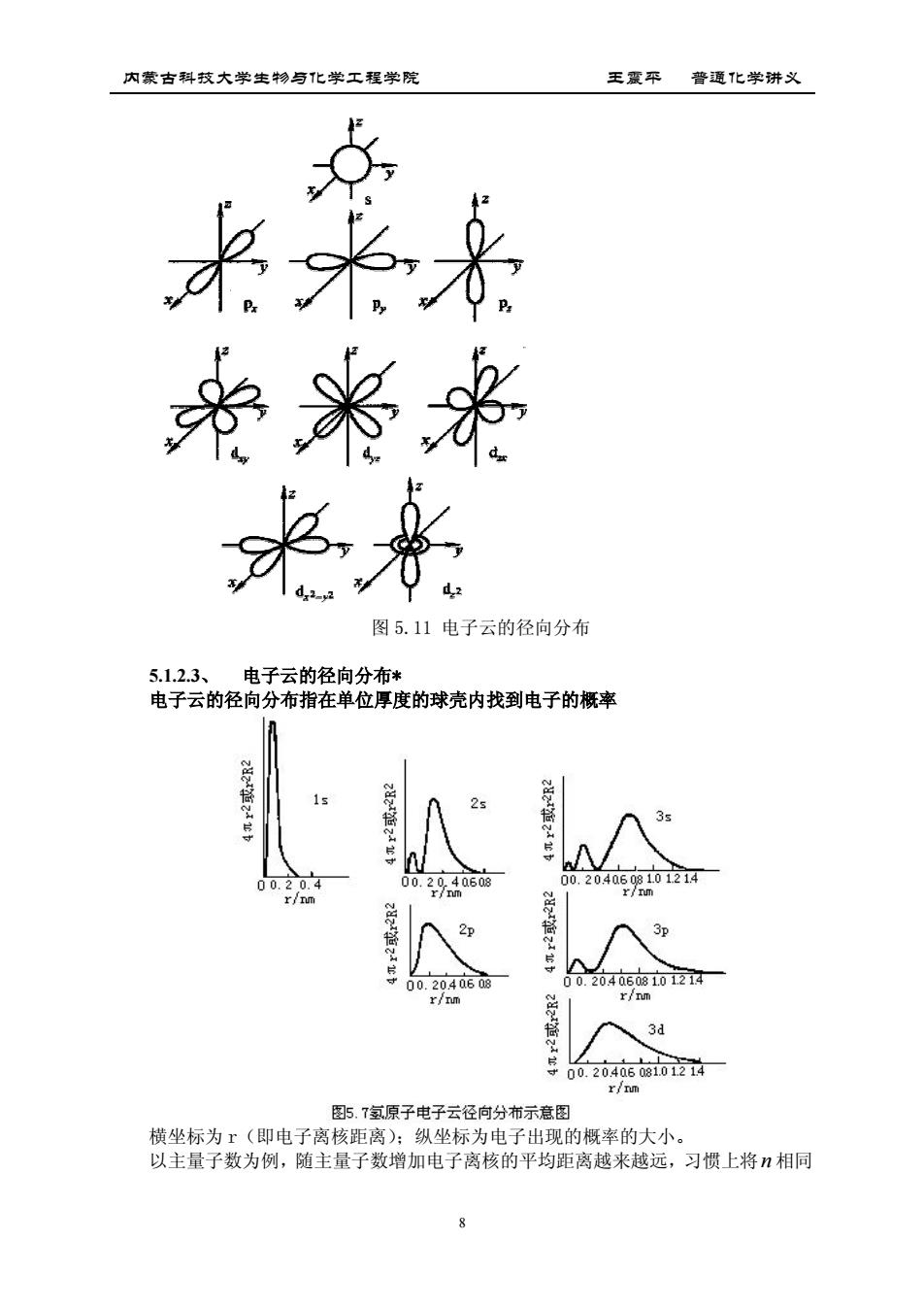
内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 帝米来 来 图5.11电子云的径向分布 5.1.2.3、 电子云的径向分布* 电子云的径向分布指在单位厚度的球壳内找到电子的概率 029406的 3p 00. r/n 3d 00.20406104 图5.T氢原子电子云径向分布示意图 横坐标为r(即电子离核距离):纵坐标为电子出现的概率的大小 以主量子数为例,随主量子数增加电子离核的平均距离越来越远,习惯上将相同
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 8 图 5.11 电子云的径向分布 5.1.2.3、 电子云的径向分布* 电子云的径向分布指在单位厚度的球壳内找到电子的概率 横坐标为 r(即电子离核距离);纵坐标为电子出现的概率的大小。 以主量子数为例,随主量子数增加电子离核的平均距离越来越远,习惯上将n 相同

内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 的轨道合称为电子层: 当主量子数相同而叫量子数增大时,例如3s,3p,3这3个电子轨道离核的平均距 离较为接近,故在同一电子层中将1相同的轨道合称为电子亚层
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 9 的轨道合称为电子层; 当主量子数相同而叫量子数增大时,例如 3s,3p,3d 这 3 个电子轨道离核的平均距 离较为接近,故在同一电子层中将l 相同的轨道合称为电子亚层
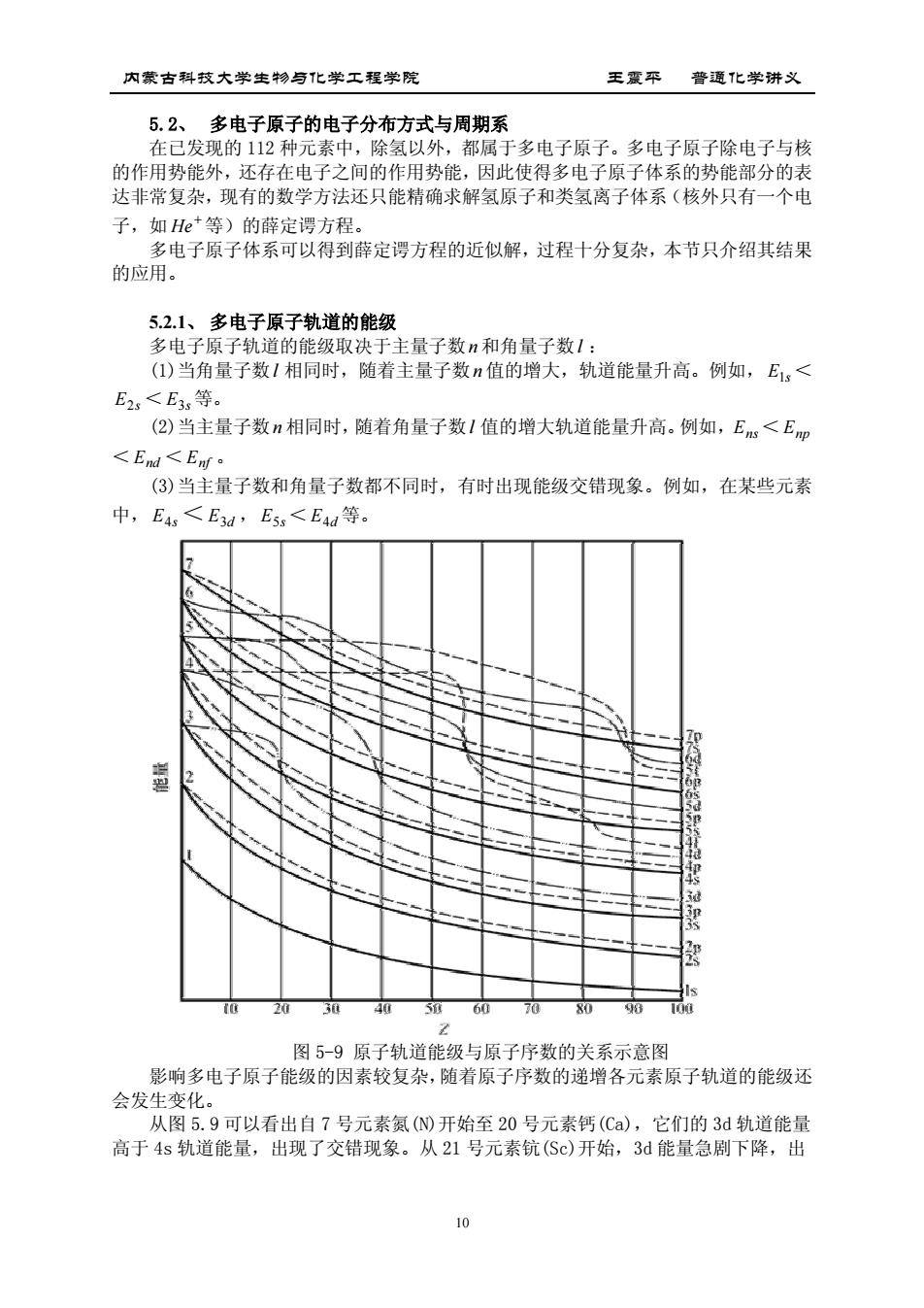
内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 5.2、多电子原子的电子分布方式与周期系 在已发现的112种元素中,除氢以外,都属于多电子原子。多电子原子除电子与核 的作用势能外,还存在电子之间的作用势能,因此使得多电子原子体系的势能部分的表 达非常复杂,现有的数学方法还只能精确求解氢原子和类氢离子体系(核外只有一个电 子,如He*等)的薛定谓方程。 多电子原子体系可以得到薛定谔方程的近似解,过程十分复杂,本节只介绍其结果 的应 5.2.1、多电子原子轨道的能级 多电子原子轨道的能级取决于主量子数n和角量子数1: ()当角量子数1相同时,随着主量子数n值的增大,轨道能量升高。例如,E< E2s<E3等。 (②)当主量子数n相同时,随着角量子数1值的增大轨道能量升高。例如,E<E <En<Ent (③)当主量子数和角量子数都不同时,有时出现能级交错现象。例如,在某些元素 中,E4s<E3d,E5s<E4d等。 图5-9原子轨道能级与原子序数的关系示意图 影响多电子原子能级的因素较复杂,随者原子序数的递增各元素原子轨道的能级还 会发生变化。 从图5.9可以看出自7号元素氯()开始至20号元素钙(C),它们的3d轨道能量 高于4s轨道能量,出现了交错现象。从21号元素钪(Sc)开始,3能量急剧下降,出
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 10 5.2、 多电子原子的电子分布方式与周期系 在已发现的 112 种元素中,除氢以外,都属于多电子原子。多电子原子除电子与核 的作用势能外,还存在电子之间的作用势能,因此使得多电子原子体系的势能部分的表 达非常复杂,现有的数学方法还只能精确求解氢原子和类氢离子体系(核外只有一个电 子,如 He 等)的薛定谔方程。 多电子原子体系可以得到薛定谔方程的近似解,过程十分复杂,本节只介绍其结果 的应用。 5.2.1、 多电子原子轨道的能级 多电子原子轨道的能级取决于主量子数n 和角量子数l : (1)当角量子数l 相同时,随着主量子数n 值的增大,轨道能量升高。例如, E1s < E2s < E3s 等。 (2)当主量子数n 相同时,随着角量子数l 值的增大轨道能量升高。例如,Ens< Enp < End < Enf 。 (3)当主量子数和角量子数都不同时,有时出现能级交错现象。例如,在某些元素 中, E4s<E3d , E5s< E4d 等。 图 5-9 原子轨道能级与原子序数的关系示意图 影响多电子原子能级的因素较复杂,随着原子序数的递增各元素原子轨道的能级还 会发生变化。 从图 5.9 可以看出自 7 号元素氮(N)开始至 20 号元素钙(Ca),它们的 3d 轨道能量 高于 4s 轨道能量,出现了交错现象。从 21 号元素钪(Sc)开始,3d 能量急剧下降,出