
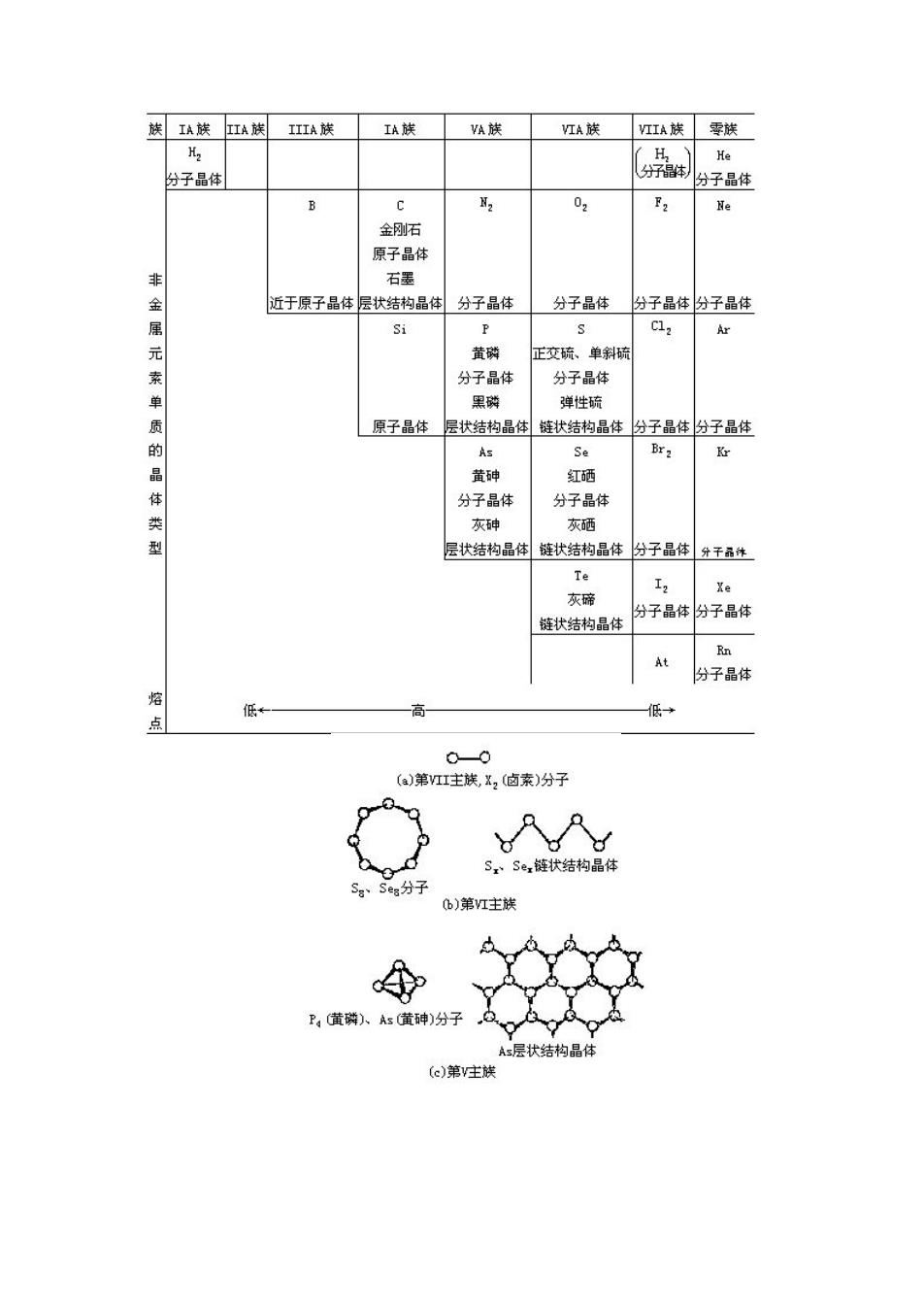
第七章高分子化合物与材料 7.1、 非金属单质和化合物的物理性质 7.1.1、 熔点、沸点、硬度和晶体结构 如5.4节所述,晶体微粒间作用力的性质和大小,对晶体的熔点、沸点、硬度等性质 有重大影响。而晶体在工程材料中占有十分重要的地位,若能事先根据单质或化合物的组 成与结构,以及组成元素在周期表中的位置,区分晶体所属类型并判别微粒间作用力的大 小,就可大致了解品体所具有的一般性质,这对选择和使用工程材料无疑是十分有益的。 面联系非金属单质及其重要化合物所属品体类别来讨论性质, 1.非金属单质 目前已知的22种非金属元素大都集中在周期表右上方,除氢①外,都在p区。非金属 元素单质的品体结构见表7.1及图7.1。除稀有气体以单原子分子存在外,所有其他非金 属单质都至少由两个原子通过共价键结合在 合而成的双原 属分子晶体 周期表中部的金刚石 硅 由很 含而成的 子品体(其4 每个原子均以4个sp杂化轨道参 与成键),硼也近于原子晶体:处于区非金 属与金属边界的磷、砷、硒、碲,甚至碳(石墨)②等出现了层状、链状等过渡型结构的多 种同素异性体。 非金属单质的熔点、沸点、硬度,按周期表呈现明显的规律:两边(左边的H,右边的 稀有气体、卤素等)的较低,中间(C、S1等原子晶体)的较高。有关数据已列在图6.1一图 这完全 他们的品体结构相适应 。例如,非 ,出 每个原子以sp杂化轨道 形成具有金刚石型结构[见图7.1()]的原子晶体,整个晶品体由共价键联系着,晶格较牢固 熔点、沸点高,硬度大。但随后的元素由于未配对电子数逐渐减少,不再以s即杂化轨道形 成原子晶体。常见的单质磷为黄磷(又称为白磷)和红磷。黄磷品体是由单个的P分子通过 分子间力结合形成的分子晶体。红磷的品体结构还没有十分肯定,有人认为它是链状结构 晶体。在一定条件下黄磷也可转变成一种黑色的同素异性体,叫做黑磷。 黑磷具有石思状 的层状结构,并有导电性。常见的单质硫(正交硫、单斜硫)晶体是由单个S分子[见图7.1)]
第七章 高分子化合物与材料 7.1、 非金属单质和化合物的物理性质 7.1.1、 熔点、沸点、硬度和晶体结构 如 5.4 节所述,晶体微粒间作用力的性质和大小,对晶体的熔点、沸点、硬度等性质 有重大影响。而晶体在工程材料中占有十分重要的地位,若能事先根据单质或化合物的组 成与结构,以及组成元素在周期表中的位置,区分晶体所属类型并判别微粒间作用力的大 小,就可大致了解晶体所具有的一般性质,这对选择和使用工程材料无疑是十分有益的。 下面联系非金属单质及其重要化合物所属晶体类别来讨论性质。 1.非金属单质 目前已知的 22 种非金属元素大都集中在周期表右上方,除氢①外,都在 p 区。非金属 元素单质的晶体结构见表 7.1 及图 7.1。除稀有气体以单原子分子存在外,所有其他非金 属单质都至少由两个原子通过共价键结合在一起。例如,H2、卤素、O2、N2都是由共价键结 合而成的双原子分子,属分子晶体;周期表中部的金刚石、硅是由很多原子结合而成的原 子晶体(其中每个原子均以 4 个 sp 3杂化轨道参与成键),硼也近于原子晶体;处于 p 区非金 属与金属边界的磷、砷、硒、碲,甚至碳(石墨)②等出现了层状、链状等过渡型结构的多 种同素异性体。 非金属单质的熔点、沸点、硬度,按周期表呈现明显的规律:两边(左边的 H2,右边的 稀有气体、卤素等)的较低,中间(C、Si 等原子晶体)的较高。有关数据已列在图 6.1~图 6.3 中。这完全与他们的晶体结构相适应。例如,非金属硅,由于每个原子以 sp 3杂化轨道 形成具有金刚石型结构[见图 7.1(d)]的原子晶体,整个晶体由共价键联系着,晶格较牢固, 熔点、沸点高,硬度大。但随后的元素由于未配对电子数逐渐减少,不再以 sp 3杂化轨道形 成原子晶体。常见的单质磷为黄磷(又称为白磷)和红磷。黄磷晶体是由单个的 P 4分子通过 分子间力结合形成的分子晶体。红磷的晶体结构还没有十分肯定,有人认为它是链状结构 晶体。在一定条件下黄磷也可转变成一种黑色的同素异性体,叫做黑磷。黑磷具有石墨状 的层状结构,并有导电性。常见的单质硫(正交硫、单斜硫)晶体是由单个S 8分子[见图 7.1(b)] 通
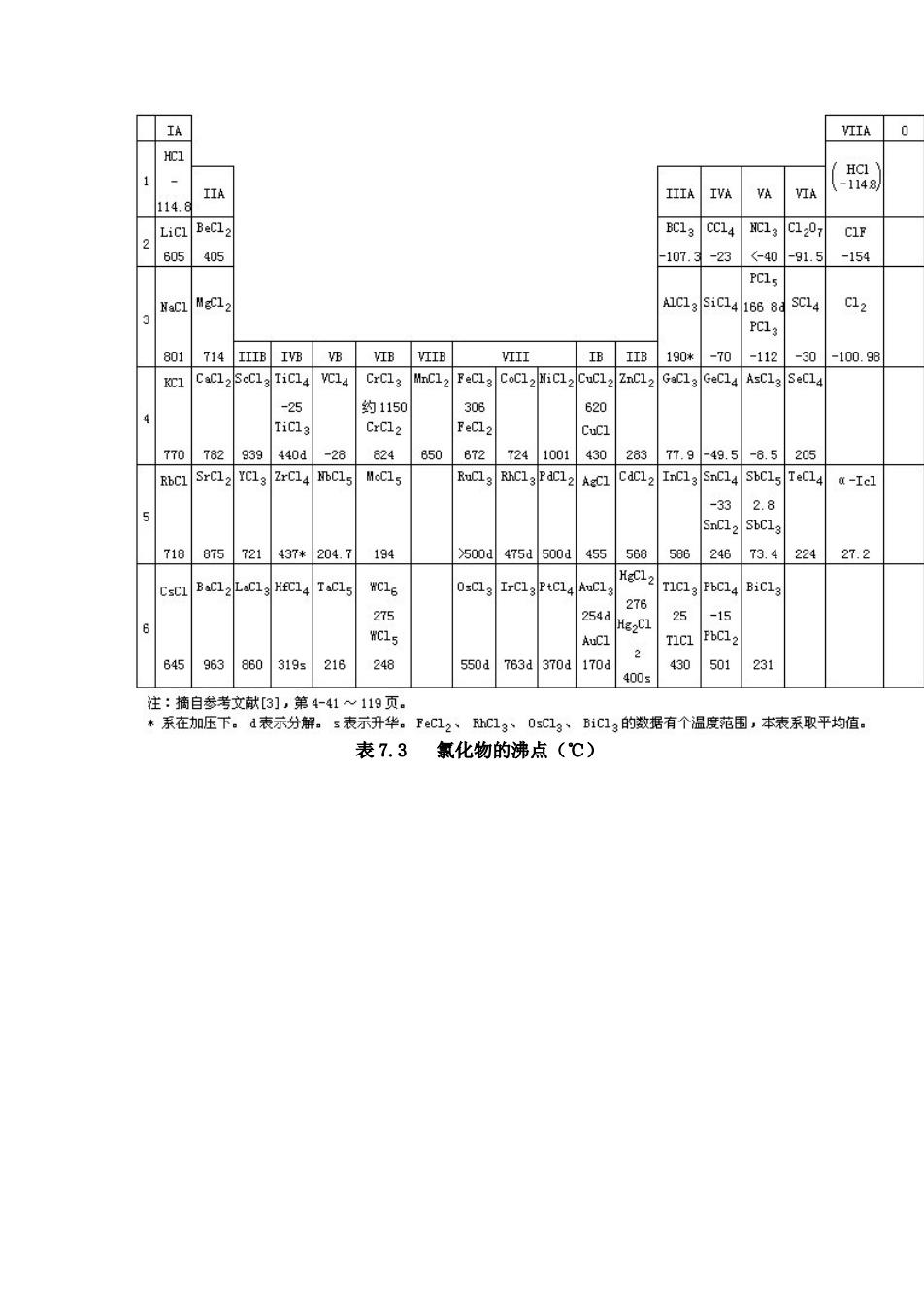
IIA族 IA族 V族 IA黄 VIA族零族 He 分子品体 份子品体 B 2 0 金石 原子晶体 石墨 金属元 近于原子品体层状结构品体 分子品体 分子品体 分子品体分子品体 Si c12 A 黄磷 正交硫、单料斜好 分子品体 分子品体 果磷 弹性硫 质的晶 原子晶 状结构晶体链状结构品体分子晶体分子品体 As 董种 红硒 分子易体 分子品体 灰砷 灰西 层状结构品体链状结构品修 分子品体外 Te 灰蹄 分子晶体份子品体 链状结构晶体 分子品体 家 低+ (a)第I主族,x,卤索)分子 SxS,链状结构品体 S、 S分子 b)第主族 P黄磷)、A黄砷)分子

()第I主族C(金图石)、S原子品体 图7】一些丰金属单质的分子或品体结构示意图 过分子间力结合而成的分子晶体。将约250℃的液态硫迅速倾入冷水,硫就凝结成可 以拉伸的弹性物质,叫做弹性硫(S)。弹性硫具有链状结构。自硅至磷(以及其后的硫、氯 氩),由于单质的晶体结构从原子晶体突然变到分子晶体,晶体中晶格微粒间的作用力骤然 变小(由原子晶体中的强大共价键变为分子晶体中的弱小分子间力),单质的熔点、沸点急 剧降低。另一条规律是,稀有气体、卤素(氧族和氮族也基本如此)的熔点、沸点从上到下 逐渐升高,这与同族元素单质从上到下分子体积增大(从而色散力增大)的方向相一致。所 以稀有气体的熔点、沸点是同周期单质中最低的,氢的熔点、沸点又是所有物质中最低的。 、Ar、He等常用作低温介质和保护气氛(见7.3.2) 2.卤化物 卤化物是指卤素与电负性比卤素小的元素所组成的二元化合物。卤化物中着重讨论氯 化物。 表7.2和表7.3中分别列出了一些氯化物的熔点和沸点。从表中可以看出,大致分成 三种情况:活泼金屈的氯化物如NaC1、KC1、BaC1,等的熔点、沸点较高: 非金属的氯化物 如PCl、Cl,、SiC,等的熔点、沸点都很低:而位于周期表中部的金属元素的氯化物如A1C1、 FeC1、CrCl、ZnC1,等的熔点、沸点介于两者之间,大多偏低。 离子型卤化物中NaC1、KCl、BaCl熔点、沸点较高,稳定性好,受热不易分解,这类 氯化物的熔融态可用作高温时的加热介质,叫做盐溶剂。CaF2、NaC1、KBr晶体可用作红 外光谱仪棱镜。位于周期表中部元素的卤化物中过渡型的A1C1、CC1及分子型的SiC1 易挥发,通常稳定性较好,但在高温时能在钢铁工件表面分解出具有活性的铝或铬、硅原 子,渗入工件表层,因而可用于渗铝、渗铬、渗硅工艺中(见6.4节);易气化的SC1、 SiHC1,(三氯硅甲烷)可被还原为硅而用于半导体硅的制取。利用共价型WIp(二碘化钨)易挥 发,且稳定性差,高温能分解为单质的性质,可在灯管中加入少量碘制得碘钨灯。当灯管 中钨丝受热升华到灯管壁(温度维持在250~650℃)时,可以与碘化合成WI2。WI:蒸气又扩 散到整个灯管,碰到高温的钨丝便重新分解,并又把钨沉积在灯丝上。这样循环不息,可 以大大提高灯的发光效率和寿命】 物质的熔点、沸点主要决定于物质的晶体结构。氯是活泼非金属,它与很活泼金属N K、B等化合形成离子型氯化物,晶态时是离子品体,晶格点上的正、负离子间作用着较 强的离子键,品格能大,因而熔点、沸点较高:氯与非金属化合形成共价型氯化物,固态 时是分子晶体,因而熔点、沸点较低。但氯与一 表7.2氯化物的熔点(℃)
过分子间力结合而成的分子晶体。将约 250℃的液态硫迅速倾入冷水,硫就凝结成可 以拉伸的弹性物质,叫做弹性硫(Sx)。弹性硫具有链状结构。自硅至磷(以及其后的硫、氯、 氩),由于单质的晶体结构从原子晶体突然变到分子晶体,晶体中晶格微粒间的作用力骤然 变小(由原子晶体中的强大共价键变为分子晶体中的弱小分子间力),单质的熔点、沸点急 剧降低。另一条规律是,稀有气体、卤素(氧族和氮族也基本如此)的熔点、沸点从上到下 逐渐升高,这与同族元素单质从上到下分子体积增大(从而色散力增大)的方向相一致。所 以稀有气体的熔点、沸点是同周期单质中最低的,氦的熔点、沸点又是所有物质中最低的。 N2、Ar、He 等常用作低温介质和保护气氛(见 7.3.2)。 2.卤化物 卤化物是指卤素与电负性比卤素小的元素所组成的二元化合物。卤化物中着重讨论氯 化物。 表 7.2 和表 7.3 中分别列出了一些氯化物的熔点和沸点。从表中可以看出,大致分成 三种情况:活泼金属的氯化物如 NaCl、KCl、BaCl2等的熔点、沸点较高;非金属的氯化物 如 PCl3、CCl4、SiCl4等的熔点、沸点都很低;而位于周期表中部的金属元素的氯化物如 AlCl3、 FeCl3、CrCl3、ZnCl2等的熔点、沸点介于两者之间,大多偏低。 离子型卤化物中 NaCl、KCl、BaCl2熔点、沸点较高,稳定性好,受热不易分解,这类 氯化物的熔融态可用作高温时的加热介质,叫做盐溶剂。CaF2、NaCl、KBr 晶体可用作红 外光谱仪棱镜。位于周期表中部元素的卤化物中过渡型的 AlCl3、CrCl2及分子型的 SiCl4 易挥发,通常稳定性较好,但在高温时能在钢铁工件表面分解出具有活性的铝或铬、硅原 子,渗入工件表层,因而可用于渗铝、渗铬、渗硅工艺中(见 6.4 节);易气化的 SiCl4、 SiHCl3(三氯硅甲烷)可被还原为硅而用于半导体硅的制取。利用共价型 WI2(二碘化钨)易挥 发,且稳定性差,高温能分解为单质的性质,可在灯管中加入少量碘制得碘钨灯。当灯管 中钨丝受热升华到灯管壁(温度维持在 250~650℃)时,可以与碘化合成 WI2。WI2蒸气又扩 散到整个灯管,碰到高温的钨丝便重新分解,并又把钨沉积在灯丝上。这样循环不息,可 以大大提高灯的发光效率和寿命。 物质的熔点、沸点主要决定于物质的晶体结构。氯是活泼非金属,它与很活泼金属 Na、 K、Ba 等化合形成离子型氯化物,晶态时是离子晶体,晶格点上的正、负离子间作用着较 强的离子键,晶格能大,因而熔点、沸点较高;氯与非金属化合形成共价型氯化物,固态 时是分子晶体,因而熔点、沸点较低。但氯与一 表 7.2 氯化物的熔点(℃)
IA VIA w09 1207 805 405 -107.-23 40 -91.5 -154 PC1s C s014 801 714 IIIB IVB VB VIB VIIB T工r IBIIB190*-70-112-30-100.9 CaClSeCl TiCl4 VC14 CrCl MnC12 FeCl CoCl2 Nicl CuCl2 ZnCl2 GaClaGeC14 AsCl SeCl4 2 约115 620 70782939 440d 824 672 100 430 283 77.9-49.5-8.9 209 TeCl4 a-Iel 2. /S 718875721437*204.7 194 500d475d500d45556858624673.4224 27.2 WCl AuC 27g 254d 2 645963860319 s216 24 550d763d 170d 430 501 231 4005 注:楠白考文献31,第4-41119页 *系在加压下。d表示分解。s表示升华。eC2、陆12、0sC2、BiC12的数据有个温度范围,本表系取平均值。 表7.3 氯化物的沸点(℃)
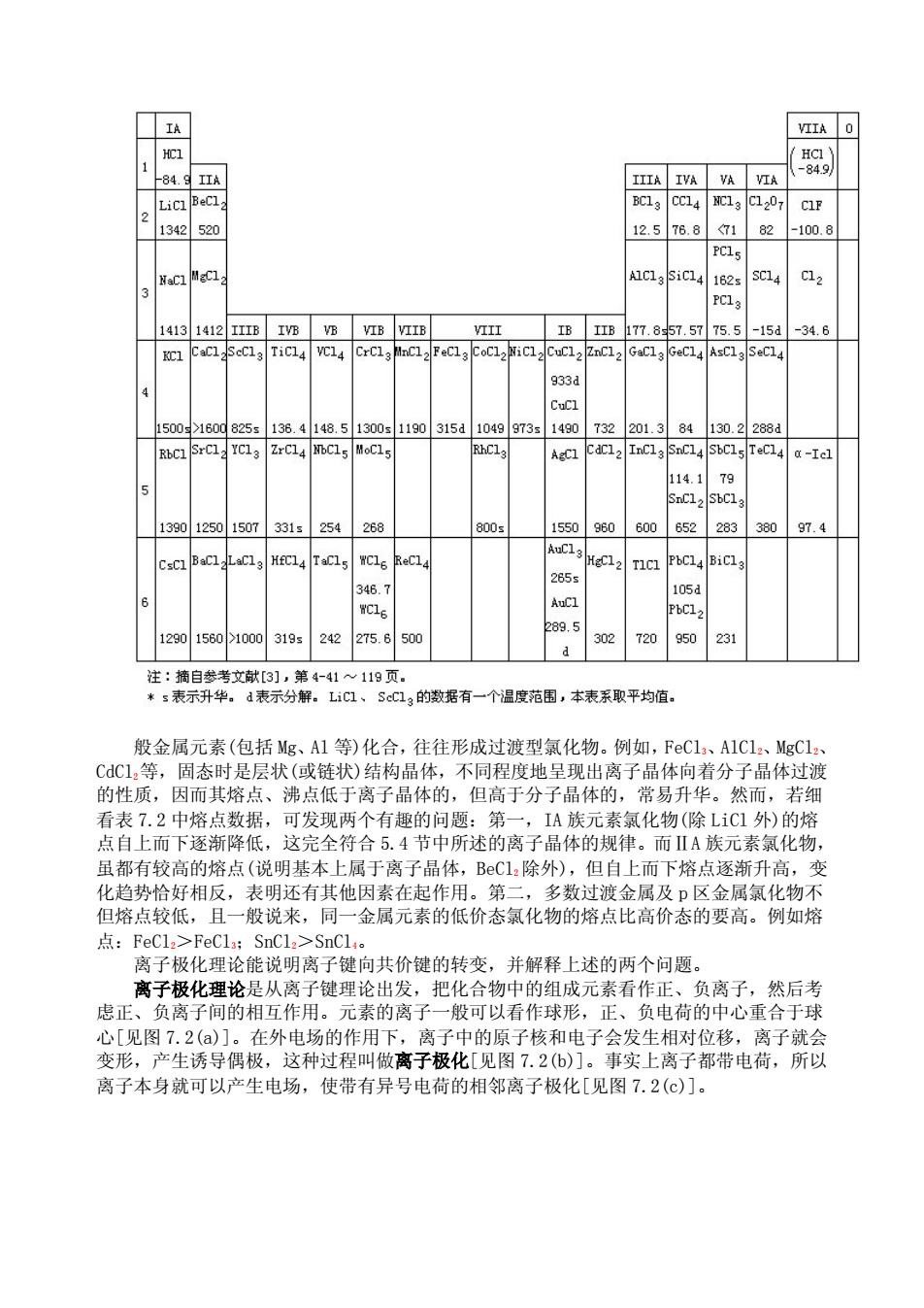
表 7.3 氯化物的沸点(℃)
849 -849 IA IIIA IVA VA VIA 520 76 82 -100. C1 182 C12 1413141 IVB VB VIB VIIB B 77 75.5 -34.6 g33. 1190315d 1049973 a-Ie] 114. 79 012501507331s 254 268 960 600 652 28 97.4 H- 346.7 105 AnC] PbC1. 129015601000319s242275.650 302720 950 231 d 注:自参考文献[3],第4-41 119页 幸s表示升华,d表示分解。LiC1、ScC1的数据有一个温度范围,本表系取平均值。 般金屈元素(包括Mg、A1等)化合,往往形成过府型氨化物。例如,FC1,、A1C1,、MgC1 CdC1,等,周态时是层状(或链状)结构晶体,不同程度地呈现出离子晶体向着分子晶体过渡 的性质, 而其熔点 、沸点低 晶体的,但高于分子晶体的 常易升华。 然而, 若织 看表7.2中熔点数据,可发现两个有趣的问题:第一,IA族元素氯化物(除LiC1外) 点自上而下逐渐降低,这完全符合5.4节中所述的离子品体的规律。而LA族元素氨化物 虽都有较高的熔点(说明基本上属于离子品体,BC1,除外),但自上而下熔点逐渐升高,变 化趋热恰好相反, 表明还有其他因素在起作用。第二,多数过渡金属及 但熔点较低,且一般说来, 一金属元素的低价态氯化物的熔点比高价 例如 点:FeCl:>FeCl:SnC1:>SnCl. 离子极化理论能说明离子键向共价键的转变,并解释上述的两个问题。 离子极化理论是从离子键理论出发,把化合物中的组成元素看作正、负离子,然后考 虑正、负离子间的相互作用。元素的离子一般可以看作球形,正、负电荷的中心重合于球 心[见图7.2()]。在外电场的作用下,离子中的原子核和电子会发生相对位移,离子就会 变形 产生诱导偶极 这 种过程叫做离子极化 图7.2b)]。 事实上离子都带电荷,所以 离子本身就可以产生电场,使带有异号电荷的相邻离子极化[见图7.2(c)]
般金属元素(包括 Mg、Al 等)化合,往往形成过渡型氯化物。例如,FeCl3、AlCl2、MgCl2、 CdCl2等,固态时是层状(或链状)结构晶体,不同程度地呈现出离子晶体向着分子晶体过渡 的性质,因而其熔点、沸点低于离子晶体的,但高于分子晶体的,常易升华。然而,若细 看表 7.2 中熔点数据,可发现两个有趣的问题:第一,IA 族元素氯化物(除 LiCl 外)的熔 点自上而下逐渐降低,这完全符合 5.4 节中所述的离子晶体的规律。而ⅡA 族元素氯化物, 虽都有较高的熔点(说明基本上属于离子晶体,BeCl2除外),但自上而下熔点逐渐升高,变 化趋势恰好相反,表明还有其他因素在起作用。第二,多数过渡金属及 p 区金属氯化物不 但熔点较低,且一般说来,同一金属元素的低价态氯化物的熔点比高价态的要高。例如熔 点:FeCl2>FeCl3;SnCl2>SnCl4。 离子极化理论能说明离子键向共价键的转变,并解释上述的两个问题。 离子极化理论是从离子键理论出发,把化合物中的组成元素看作正、负离子,然后考 虑正、负离子间的相互作用。元素的离子一般可以看作球形,正、负电荷的中心重合于球 心[见图 7.2(a)]。在外电场的作用下,离子中的原子核和电子会发生相对位移,离子就会 变形,产生诱导偶极,这种过程叫做离子极化[见图 7.2(b)]。事实上离子都带电荷,所以 离子本身就可以产生电场,使带有异号电荷的相邻离子极化[见图 7.2(c)]