
2.原子氢 原子氢的还原性比氢单质要强得多,在常温下能与GeS1As Sb等单质直接化合。 >与As;S等非金属单质的反应 As+3H→AsH3 S+2H→H2S >与金属氧化物或氯化物的反应 CuCl,2H Cu 2HCI >与含氧酸盐的反应 BaS04+8H→BaS+4H2O
2.原子氢 原子氢的还原性比氢单质要强得多,在常温下能与Ge Sn As Sb等单质直接化合。 ➢ 与As;S等非金属单质的反应 As + 3H → AsH3 S + 2H → H2S ➢ 与金属氧化物或氯化物的反应 CuCl2 + 2H → Cu + 2HCl ➢ 与含氧酸盐的反应 BaSO4 + 8H → BaS + 4H2O
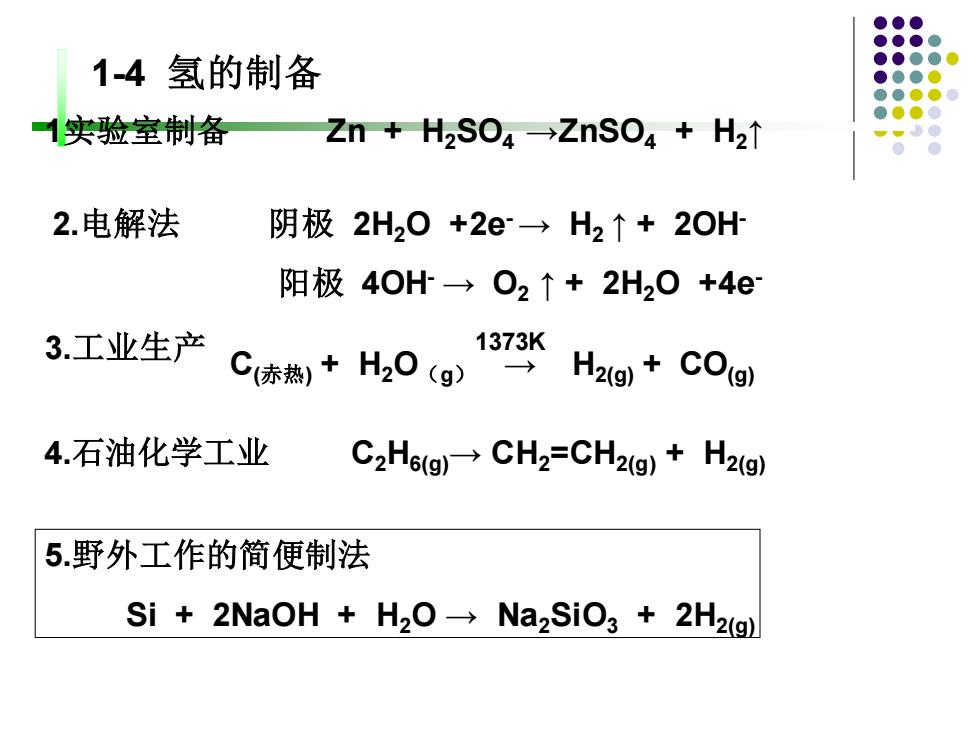
1-4氢的制备 1实验室制备 Zn+H2S04→ZnS04+H2t 2.电解法 阴极2H20+2e→H2↑+2OH 阳极40H→O2↑+2H20+4e 3.工业生产 1373K C(陈热+H20(g)⊙SH2g+C0gl 4.石油化学工业 C2H6(g)CH2=CH2(g)+H2(g) 5.野外工作的简便制法 Si 2NaOH H2O Na2SiO3+2H2(g)
1实验室制备 Zn + H2SO4 →ZnSO4 + H2↑ 2.电解法 阴极 2H2O +2e-→ H2 ↑ + 2OH- 阳极 4OH- → O2 ↑ + 2H2O +4e- 3.工业生产 C(赤热) + H2O(g) → H2(g) + CO(g) 1373K 1-4 氢的制备 4.石油化学工业 C2H6(g)→ CH2=CH2(g) + H2(g) 5.野外工作的简便制法 Si + 2NaOH + H2O → Na2SiO3 + 2H2(g)