
故溶液中氯化钠的摩尔分数,质量摩尔浓度和物质的量 浓度分别为: x (NaCl)=n (NaCl)n (NaCl)+n (H20 =0.264mol0.264mol+4.694mo1=0.0532 m(NaC1)=n(NaCl)m(H20)=0.264mol84.6×10 3kg=3.12mol kg 1 c (NaCl)=n (NaCl)V=0.264mol90.17X10 3L=2.92mol-L1 溶液中氯化钠的摩尔分数,质量摩尔浓度和物质的量浓 度分别为:0.0532、3.12 mol.kg1、2.92molL1
故溶液中氯化钠的摩尔分数,质量摩尔浓度和物质的量 浓度分别为: x(NaCl)=n(NaCl)n(NaCl)+n(H2O) =0.264mol0.264mol+4.694mol=0.0532 m(NaCl)=n(NaCl)m(H2O)=0.264mol84.6×10 3kg=3.12mol·kg 1 c(NaCl)=n(NaCl)V=0.264mol90.17×10 3L=2.92mol·L 1 溶液中氯化钠的摩尔分数,质量摩尔浓度和物质的量浓 度分别为:0.0532、3.12mol·kg 1、2.92mol·L 1

§3-2稀溶液的通性 讨论由难挥发性溶质B和溶剂A组成的溶液所弔引 起溶液的蒸气压下降、沸点上升和凝固点下降 以及溶液渗透压等。 干燥剂.抗凝剂、冷冻剂、反渗透、科学实验 技术等都与这些性质有关。 难挥发的非电解质稀溶液 依数性的含义 难挥发的非电解质的稀溶液的性质与浓度(或 者是与溶液中的“粒子数”的多少)有关而与溶 质的性质无关.Ostwald称其为”依数性
§3-2 稀溶液的通性 讨论由难挥发性溶质B和溶剂A组成的溶液所引 起溶液的蒸气压下降、沸点上升和凝固点下降, 以及溶液渗透压等。 干燥剂.抗凝剂、冷冻剂、反渗透、科学实验 技术等都与这些性质有关。 一 难挥发的非电解质稀溶液 依数性的含义 难挥发的非电解质的稀溶液的性质与浓度(或 者是与溶液中的“粒子数”的多少)有关而与溶 质的性质无关. Ostwald 称其为“依数性”
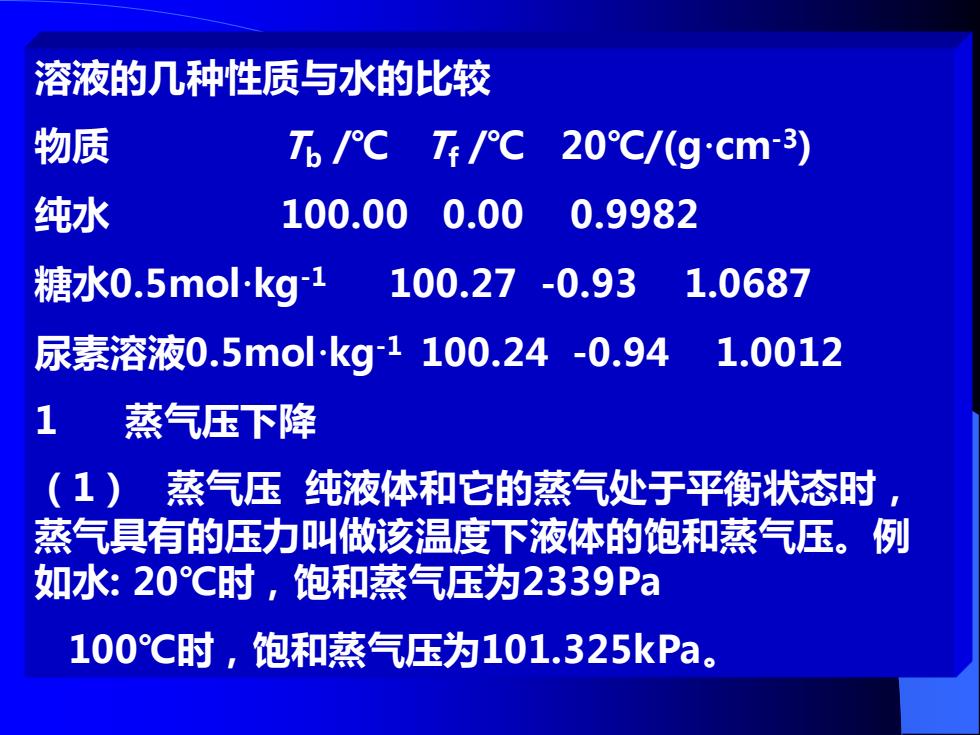
溶液的几种性质与水的比较 物质 T6/℃TF/C 20℃/(gcm-3) 纯水 100.000.00 0.9982 糖水0.5mokg1 100.27-0.93 1.0687 尿素溶液0.5 mol-kg1100.24-0.94 1.0012 1蒸气压下降 (1)蒸气压纯液体和它的蒸气处于平衡状态时, 蒸气具有的压力叫做该温度下液体的饱和蒸气压。例 如水:20°℃时,饱和蒸气压为2339Pa 100°℃时,饱和蒸气压为101.325kPa
溶液的几种性质与水的比较 物质 Tb /℃ Tf /℃ 20℃/(g·cm-3) 纯水 100.00 0.00 0.9982 糖水0.5mol·kg-1 100.27 -0.93 1.0687 尿素溶液0.5mol·kg-1 100.24 -0.94 1.0012 1 蒸气压下降 (1) 蒸气压 纯液体和它的蒸气处于平衡状态时, 蒸气具有的压力叫做该温度下液体的饱和蒸气压。例 如水: 20℃时,饱和蒸气压为2339Pa 100℃时,饱和蒸气压为101.325kPa

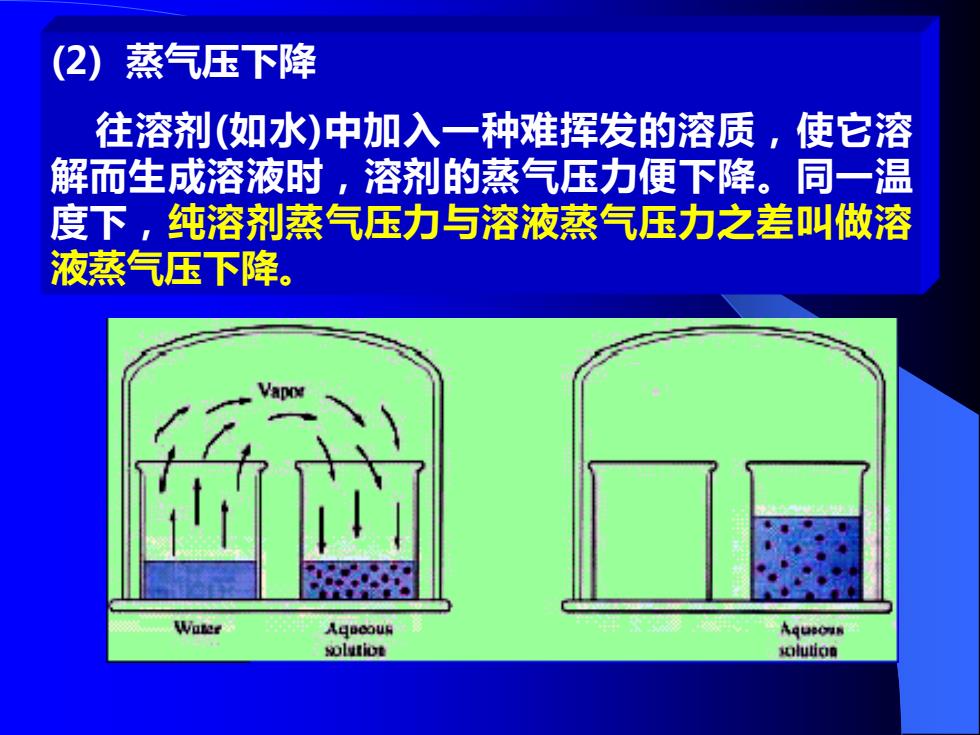
2) 蒸气压下降 往溶剂(如水)中加入一种难挥发的溶质,使它溶 解而生成溶液时,溶剂的蒸气压力便下降。同一温 度下,纯溶剂蒸气压力与溶液蒸气压力之差叫做溶 液蒸气压下降。 Water Ageoous Aque0m时 olvtiot slution
(2) 蒸气压下降 往溶剂(如水)中加入一种难挥发的溶质,使它溶 解而生成溶液时,溶剂的蒸气压力便下降。同一温 度下,纯溶剂蒸气压力与溶液蒸气压力之差叫做溶 液蒸气压下降