
(一)螯合反应与亲水性 金属离子在未成螯合物之前,受水分子极性 用,以水合离子形式存在,为亲水性,难溶于有 机溶剂,故不好直接用有机溶剂萃取。 选择适当的金属螯合剂可将金属离子变为疏 水性的金属螯合物,然后再萃取。 物质能否有亲水性,主要看其是否能与水子 形成氢键
(一)螯合反应与亲水性 金属离子在未成螯合物之前,受水分子极性作 用,以水合离子形式存在,为亲水性,难溶于有 机溶剂,故不好直接用有机溶剂萃取。 选择适当的金属螯合剂可将金属离子变为疏 水性的金属螯合物,然后再萃取。 物质能否有亲水性,主要看其是否能与水子 形成氢键
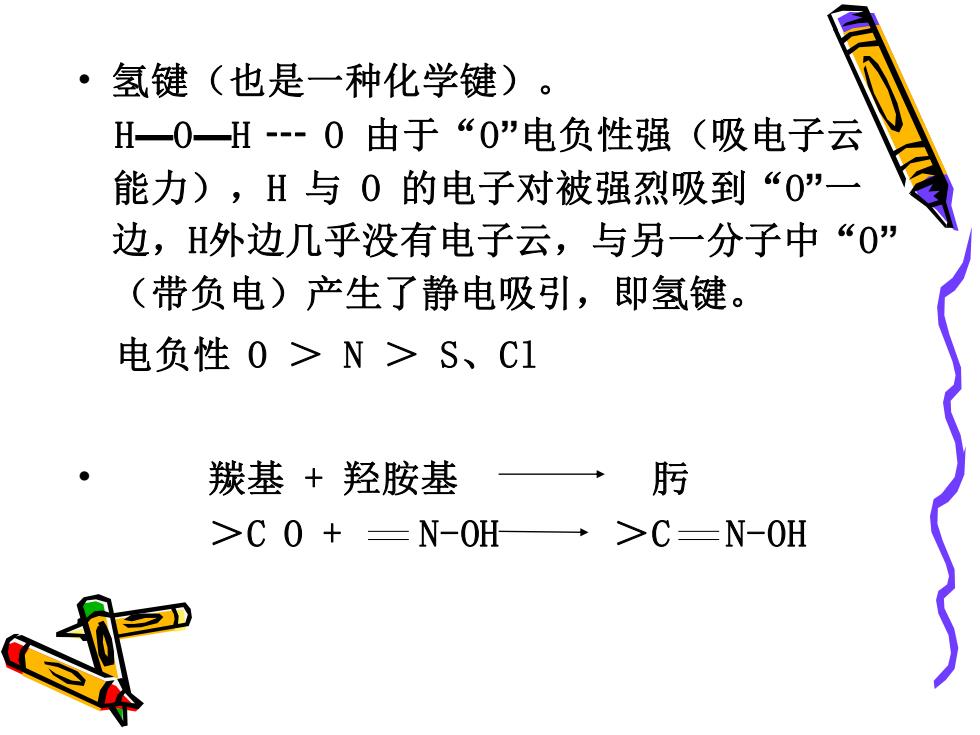
·氢键(也是一种化学键)。 H一0一H-0由于“0”电负性强(吸电子云 能力),H与0的电子对被强烈吸到“0一 边,H外边几乎没有电子云,与另一分子中“0” (带负电)产生了静电吸引,即氢键。 电负性0>N>S、C1 羰基+羟胺基 肟 >C 0+-N-0H >C-N-OH
• 氢键(也是一种化学键)。 H—O—H ┄ O 由于“O”电负性强(吸电子云 能力),H 与 O 的电子对被强烈吸到“O”一 边,H外边几乎没有电子云,与另一分子中“O” (带负电)产生了静电吸引,即氢键。 电负性 O > N > S、Cl • 羰基 + 羟胺基 肟 >C O + N-OH >C N-OH

(二)萃取分离的基本原理 1.分配系数PD、K 萃取时,有两相互不相溶,一相为水相,一相 为有机相,物质A在两相中存在量不同。在一 定温度下,分配达到平衡。A在两相中活度比不 再变,即PD,K为常数。 ·PDA=aA有/aA水 浓度很低时,用浓度代替活度α KD=[A]有/[A]水
(二)萃取分离的基本原理 1. 分配系数 PD、KD 萃取时,有两相互不相溶,一相为水相,一相 为有机相,物质A 在两相中存在量不同。在一 定温度下,分配达到平衡。A在两相中活度比不 再变,即PD,KD为常数。 • PDA = αA有/αA水 浓度很低时,用浓度代替活度 α • KD = [A]有 / [A]水
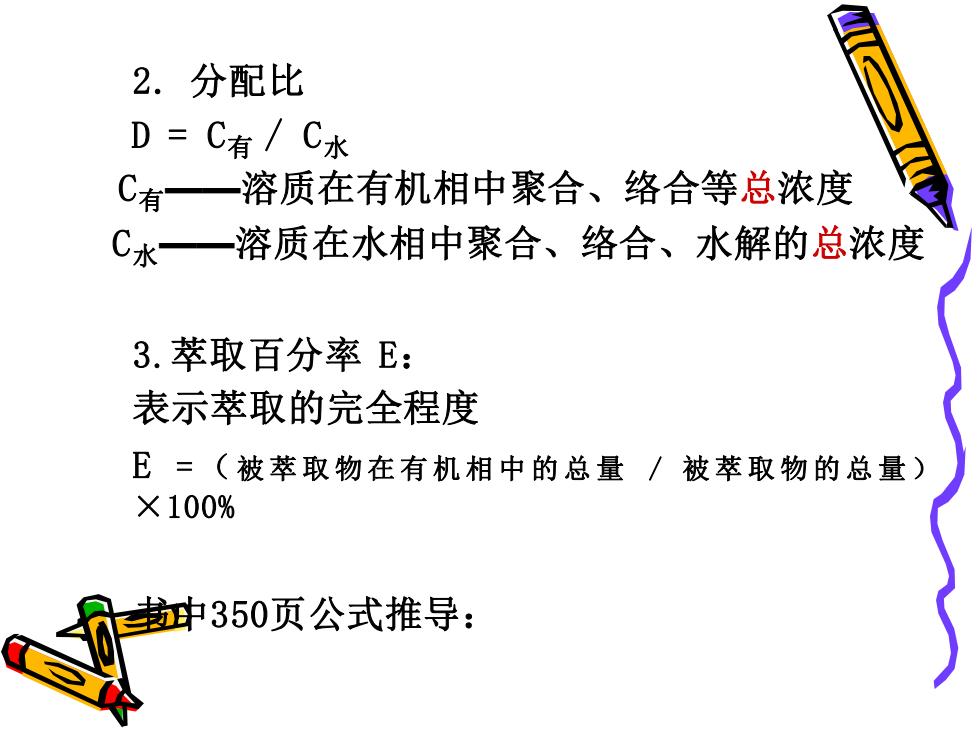
2.分配比 D=C有/C水 C有一 溶质在有机相中聚合、络合等总浓度 C水一溶质在水相中聚合、络合、水解的总浓度 3.萃取百分率E: 表示萃取的完全程度 E=(被萃取物在有机相中的总量/被萃取物的总量) ×100% 中350页公式推导:
2. 分配比 D = C有 / C水 C有——溶质在有机相中聚合、络合等总浓度 C水——溶质在水相中聚合、络合、水解的总浓度 3.萃取百分率 E: 表示萃取的完全程度 E = (被萃取物在有机相中的总量 / 被萃取物的总量 ) ×100% 书中350页公式推导:
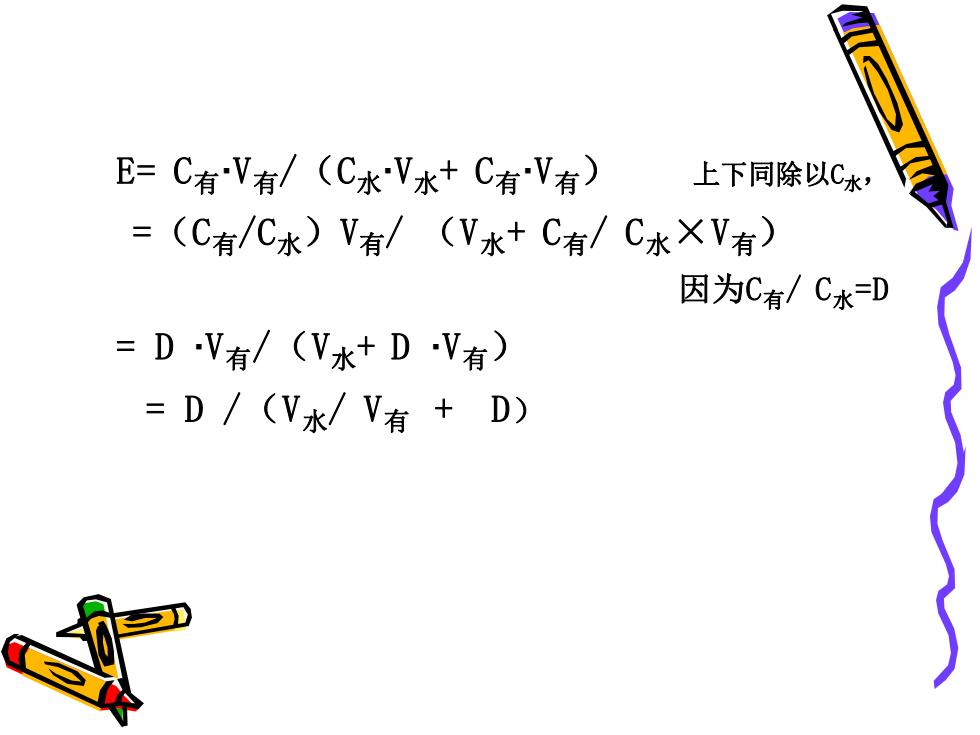
E=C有V有/(C水V水+C有V有) 上下同除以C水, =(C有/C水)V有/(V水+C有/C水XV有) 因为C有/C水=D =DV有/(V水+DV有) =D/(V水/V有+D)
E= C有·V有/(C水·V水+ C有·V有) 上下同除以C水, =(C有/C水)V有/ (V水+ C有/ C水×V有) 因为C有/ C水=D = D ·V有/(V水+ D ·V有) = D /(V水/ V有 + D)