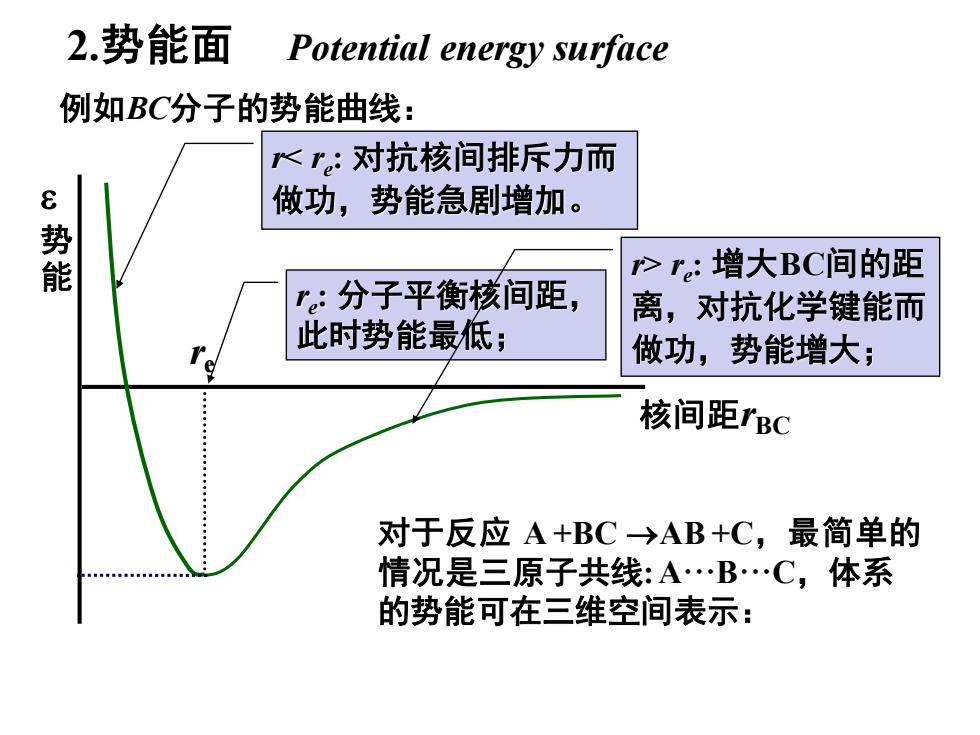
2.势能面 Potential energy surface 例如BC分子的势能曲线: ~r。:对抗核间排斥力而 e势能 做功,势能急剧增加。 >re:增大BC间的距 r:分子平衡核间距, 离,对抗化学键能而 此时势能最低; 做功,势能增大; 核间距rBC 对于反应A+BC→AB+C,最简单的 情况是三原子共线:A.B.C,体系 的势能可在三维空间表示:
2.势能面 Potential energy surface 势 能 核间距rBC 例如BC分子的势能曲线: 对于反应 A +BC →AB +C,最简单的 情况是三原子共线: A···B···C,体系 的势能可在三维空间表示: re re : 分子平衡核间距, 此时势能最低; r> re : 增大BC间的距 离,对抗化学键能而 做功,势能增大; r< re : 对抗核间排斥力而 做功,势能急剧增加

以简单反应为例: A+BC→A.B.C]→AB+C 当A原子接近B-C分子时,就开始使B-C分子间 的键减弱,同时,开始生成新的A-B键。在这个 过程未完成之前,系统形成一个过渡态即活化络 合物A.B.C]≠,此时前一个键尚未完全断开, 后一个键又未完全形成。在这个过程中,反应系 统的势能变化
A + BC [A···B···C]→AB + C 当A原子接近B-C分子时,就开始使B-C分子间 的键减弱,同时,开始生成新的A-B键 。在这个 过程未完成之前,系统形成一个过渡态即活化络 合物[A···B···C],此时前一个键尚未完全断开, 后一个键又未完全形成。在这个过程中,反应系 统的势能变化。 以简单反应为例:

以三原子反应为例: A+B-C=[A.B.C]f→A-B+C 当A原子与双原子分子BC反应时,首先形成三 原子分子的话化络合物,该络合物的势能是3个内 坐标的函数 Ep=Ep(IAB,rBC,cA) 或 Ep=Ep(IAB,BC,∠ABC) 这要用四维图表示
以三原子反应为例: A B C [A B C] A B C + − → − + 当A原子与双原子分子BC反应时,首先形成三 原子分子的活化络合物,该络合物的势能是3个内 坐标的函数 P P AB BC CA E E r r r = ( , , ) 这要用四维图表示 P P AB BC ABC 或 ( , , ) E E r r =
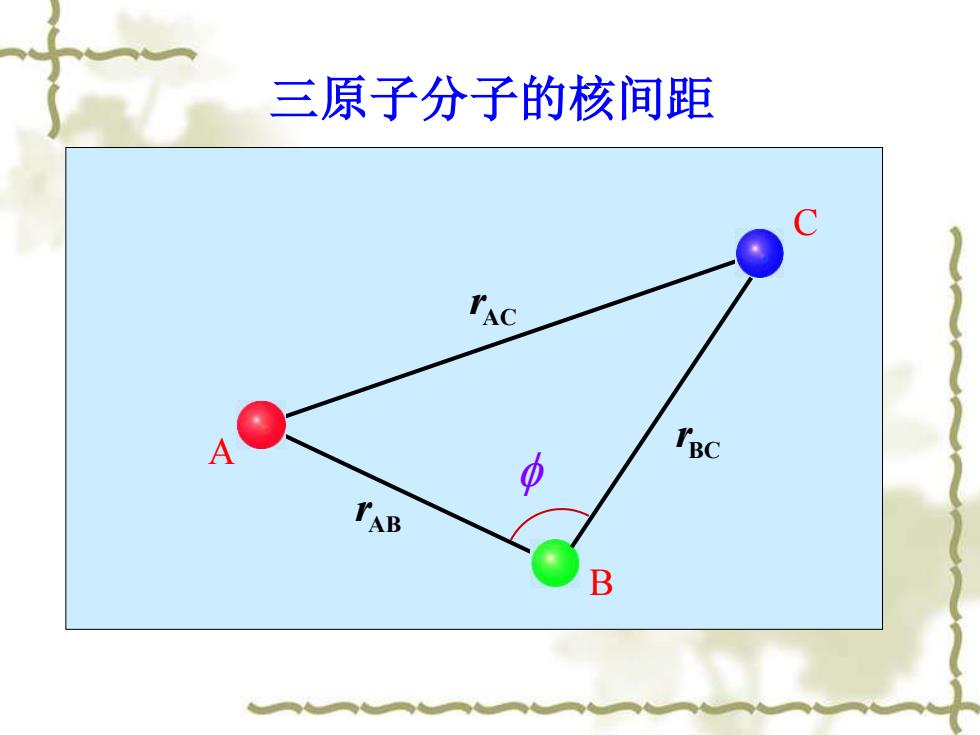
三原子分子的核间距 TAC TpC B
三原子分子的核间距 AB r AC r A B C BC r
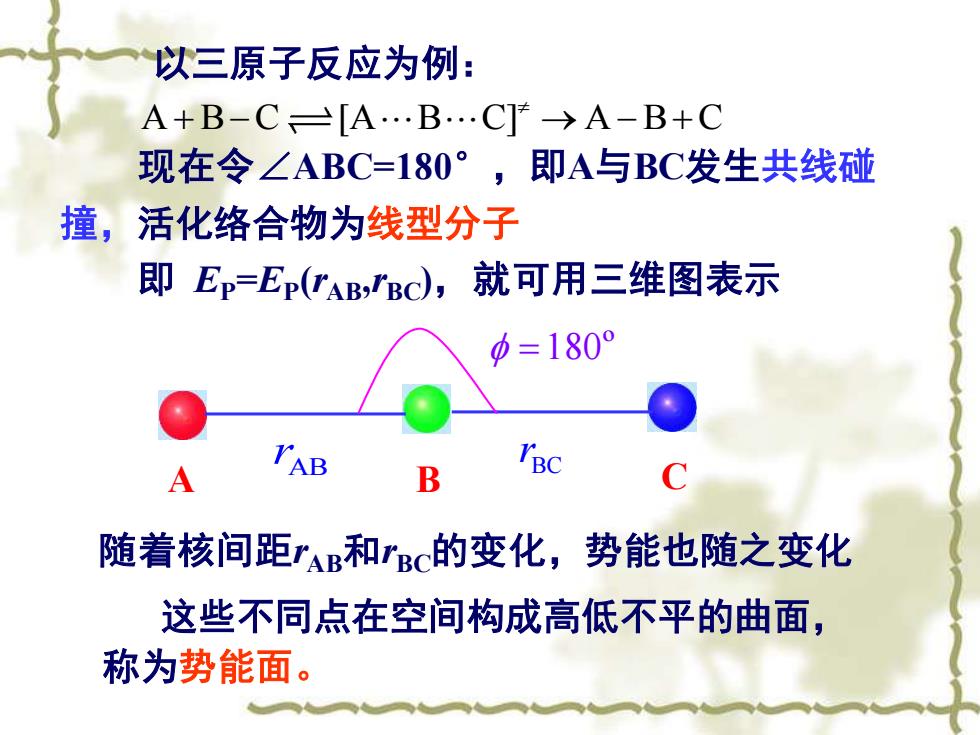
以三原子反应为例: A+B-C=[A.B.C]→A-B+C 现在令∠ABC=180°,即A与BC发生共线碰 撞,活化络合物为线型分子 即Ep=Er(rAB,BC),就可用三维图表示 p=180° A B B 随着核间距rAB和rBC的变化,势能也随之变化 这些不同点在空间构成高低不平的曲面, 称为势能面
以三原子反应为例: A B C [A B C] A B C + − → − + 现在令∠ABC=180° ,即A与BC发生共线碰 撞,活化络合物为线型分子 即 EP=EP (rAB,rBC),就可用三维图表示 A B C AB r BC r =180º 随着核间距rAB和rBC的变化,势能也随之变化 这些不同点在空间构成高低不平的曲面, 称为势能面