
k=πdBL 8RT π4 这就是根据简单碰撞理论导出的速率常数计算式 在常温常压下,碰撞频率约为1035m3.s1 由于不是每次碰撞都能发生反应,所以要 乘以有效碰撞分数q E b.0 dt g=e RT L .e E RT dt L 8RT E πdkL RT CACB=kCACB πu
这就是根据简单碰撞理论导出的速率常数计算式 2 AB 8RT k d L = 在常温常压下,碰撞频率约为 35 3 1 10 m s − − 由于不是每次碰撞都能发生反应,所以要 乘以有效碰撞分数q d A AB d c Z r q t L = − = e E RT q − = A AB d e d E RT c Z t L r − = − = A 2 AB A B B 8 e E RT RT d L c c kc c − = =

r=πdL 8RT E RT CACB πu Ea 对照Arrhenius公式 k=Ae RT k=πdL 8RT 、 RT =Ae RT πu 8RT A=πdL πU 碰撞理论说明了经验式中的指前因子相当于 碰撞频率,故又称为频率因子
对照Arrhenius公式 Ea RT k Ae − = 碰撞理论说明了经验式中的指前因子相当于 碰撞频率,故又称为频率因子 2 AB 8 e e E E RT RT RT k d L A − − = = 2 AB 8RT A d L = 2 AB A B 8 e E RT RT r d L c c − =

4.概率因子(probability factor) 由于简单碰撞理论所采用的模型过于简单,没有 考虑分子的结构与性质,所以用概率因子来校正理论 计算值与实验值的偏差。 P=k(实验)k(理论) 概率因子又称为空间因子或方位因子。 则速率常数的计算式为 k(T)=p.4.exp-R7】
4.概率因子(probability factor) 概率因子又称为空间因子或方位因子。 由于简单碰撞理论所采用的模型过于简单,没有 考虑分子的结构与性质,所以用概率因子来校正理论 计算值与实验值的偏差。 P=k(实验)/k(理论) 则速率常数的计算式为 ( ) a exp E k T P A RT = −

理论计算值与实验值发生偏差的原因主要有: ()从理论计算认为分子已被活化,但由于有的分 子只有在某一方向相撞才有效; (2)有的分子从相撞到反应中间有一个能量传递 过程,分子碰撞后需要一定的时间进行内部能量传 递以使最弱的键破裂,若这时又与另外的分子相撞 而失去能量,则反应仍不会发生 (3)有的分子在能引发反应的化学键附近有较大的 原子团,由于位阻效应,减少了这个键与其它分子 相撞的机会等等
(1) 从理论计算认为分子已被活化,但由于有的分 子只有在某一方向相撞才有效; (2) 有的分子从相撞到反应中间有一个能量传递 过程,分子碰撞后需要一定的时间进行内部能量传 递以使最弱的键破裂,若这时又与另外的分子相撞 而失去能量,则反应仍不会发生; (3) 有的分子在能引发反应的化学键附近有较大的 原子团,由于位阻效应,减少了这个键与其它分子 相撞的机会等等。 理论计算值与实验值发生偏差的原因主要有:
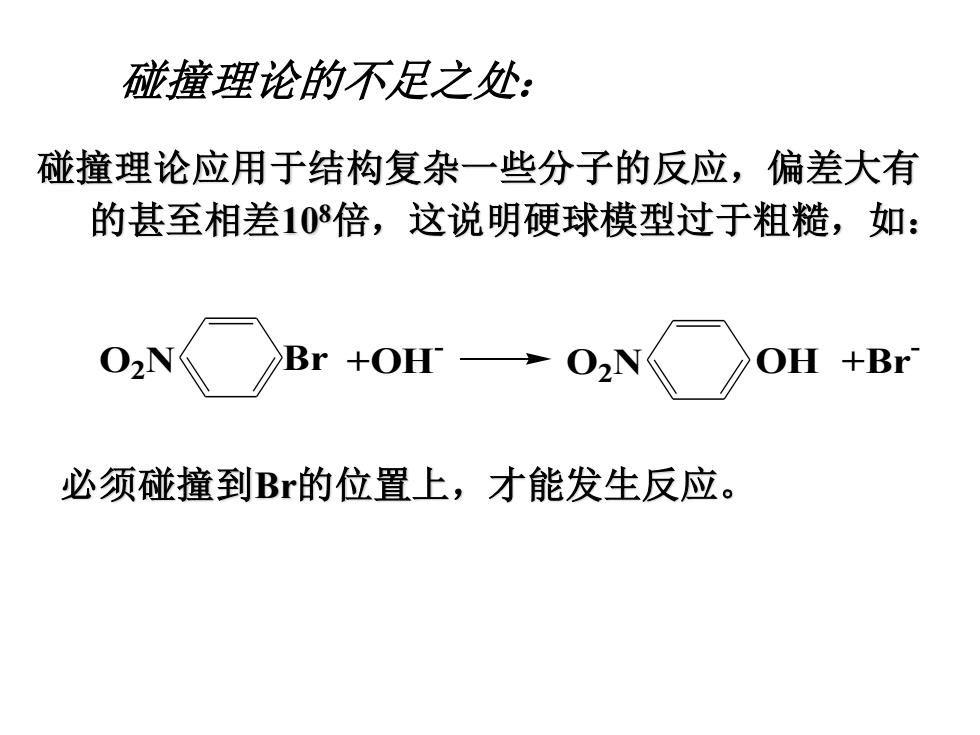
碰撞理论的不足之处: 碰撞理论应用于结构复杂一些分子的反应,偏差大有 的甚至相差108倍,这说明硬球模型过于粗糙,如: 02N Br +OH 02N OH +Br 必须碰撞到B的位置上,才能发生反应
碰撞理论应用于结构复杂一些分子的反应,偏差大有 的甚至相差108倍,这说明硬球模型过于粗糙,如: 碰撞理论的不足之处: 必须碰撞到Br的位置上,才能发生反应。 O2N Br O2N OH +Br - +OH -