
化工基础 15 ·2、惰气含量 X NH3 (1-XNH; x) -PK@+1) X NH3 r.5 [(1-%n,)(1-x)- -P-Kr(+1) X NH3 =P+i-) 当T、P一定时,P、K=const, Xi,XNH3 如:30.4MPa,450℃时,若r=3,由上式计算得: x=0.15 0.1 0 XNH3=26 31 36(%) 循环气要定期排放。 ☑✉D☒?
2 、惰气含量 2 1.5 2 (r 1) · · (1 ) 3 3 r P K x x x p NH i NH 2 1.5 2 (r 1) · · [(1 )(1 ) ] 3 3 3 r P K x x x x x p NH i NH i NH 2 2 1.5 2 (1 ) (r 1) · · (1 ) 3 3 p i NH NH x r P K x x 当 T 、 P 一定时, P 、 K p = const , xi ↑, xNH3 ↓ 如: 30.4MPa , 450℃ 时,若 r = 3 ,由上式计算得: xi = 0.15 0.1 0 xNH3 = 26 31 36 (%) ∴ 循环气要定期排放
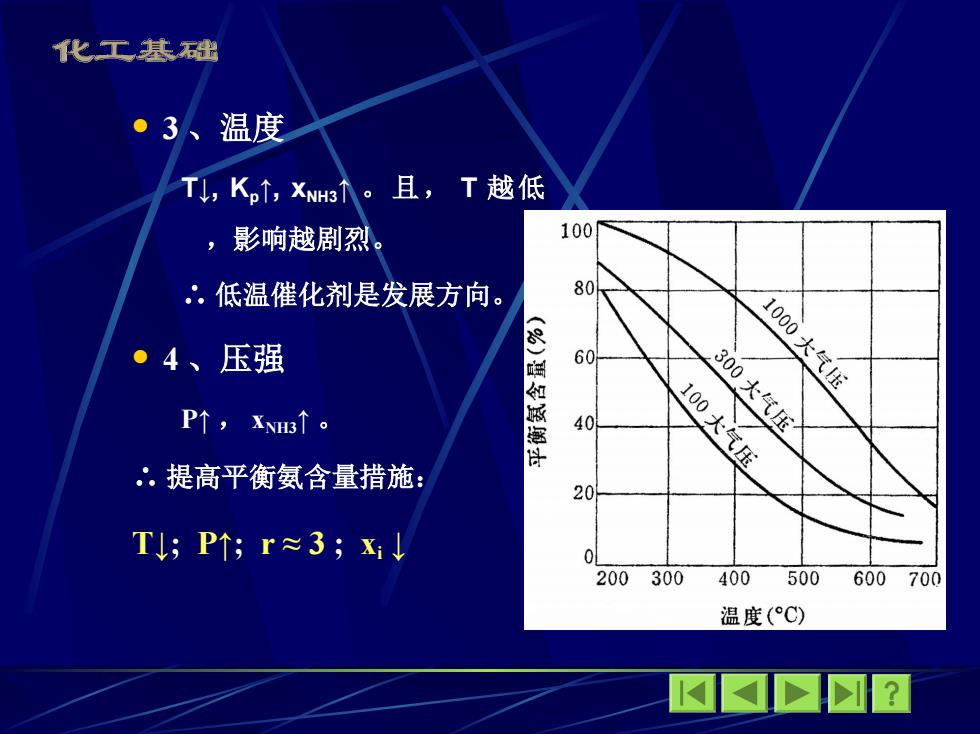
化工基础 ·3、温度 T,K,↑,xN小。且,T越低 ,影响越剧烈。 100 .低温催化剂是发展方向。 80 10 ●4、压强 (%) 60 大气压 如 P↑,Xs↑。 40 300大气压 许 100大气压 .提高平衡氨含量措施: 20 T;P↑;r≈3;xJ 0 200300 400500 600700 温度(°C) M✉☒?
3 、温度 T↓, Kp↑, xNH3↑ 。且, T 越低 ,影响越剧烈。 ∴ 低温催化剂是发展方向。 4 、压强 P↑ , xNH3↑ 。 ∴ 提高平衡氨工业含量措施: T↓; P↑; r ≈ 3 ; xi ↓

化工基础 §3氨合成的动力学基础 ●一、 催化剂 主要成分:Fe0Fe2O3 活性组分:Fe .使用前需还原: Fe304+4H2= 3Fe+4H,O 助催化剂:A山,O3、 Cao Mgo r=3,500℃,300atm: 等。 无催化剂,10mim,氨体积百分含量:4×10-1% 催化剂失活的原因: 10h, 1×10-9% Fe-Cat 5s, 7% (1)催化剂的老化 10s, 10% (2)催化剂的中毒 15s, 12% (3)机械杂质覆盖
§ 3 氨工业 动 学 础 合成的 力 基 一、催化剂 * 主要成分: FeO·Fe2O3 活性组分: Fe ∴ 使用前需还原: Fe3O4 + 4 H2 3 Fe + 4 H2O * 助催化剂: Al2O3 、 K2O 、 CaO 、 MgO 等。 催化剂失活的原因: ⑴ 催化剂的老化 ⑵ 催化剂的中毒 ⑶ 机械杂质覆盖 r = 3, 500 , 300atm ℃ : 无催化剂, 10min ,氨工业体积百分含量: 4×10-11% 10h , 1×10-9% Fe - Cat , 5s , 7% 10s , 10% 15s , 12%

化工基础 。二、反应机理和动力学方程 N2+[K-Fe→NIK-Fe] N2吸附 N2IK-Fe→2N[K-Fe] N2断键 2N[K-Fe]H2-2NH[K-Fe] 2NH[K-Fe]H2-2NH2[K-Fe] 2NH2[K-Fe]H2-2NH3[K-Fe] 2NH3[K-Fe]2NH3 [K-Fe] N2+3H2→2NH3 氮气的活性吸附是最慢的控制步骤。 TNHs =kipNa p 2-k3P 1.5 当Fe作为催化剂时,氨合成的反应速率: PN PH2 ✉☑?
二、反应机理和动力学方程 N2 + [K-Fe] → N2 [K-Fe] N2吸附 N2 [K-Fe] → 2N[K-Fe] N2断键 2N[K-Fe] + H2 → 2NH[K-Fe] 2NH[K-Fe] + H2 → 2NH2 [K-Fe] 2NH2 [K-Fe] + H2 → 2NH3 [K-Fe] 2NH3 [K-Fe] → 2NH3 + [K-Fe] 1.5 2 1.5 1 2 3 3 2 3 2 H NH NH H NH N p p k p p r k p N2 + 3H2 → 2NH3 氮气的活性吸附是最慢的控制步骤。 当 Fe 作为催化剂时,氨工业合成的反应速率: