
化工基础 。二、原则流程 合成氨的原料:N2一空气 H2←-油、气水 氨的合成具有两大特点: (I)耗能; (2)低转化率,∴需分离循环系统。 òN òN⑥6ú 3h0》 核心:合成。 M网C☒?
二、原则流程 合成氨工业的原料: N2 ← 空气 H2 ← 油、气、水 氨工业的合成具有两大特点: ⑴ 耗能;下 ⑵ 低转化率,∴需分离循环系统。 核心:合成

化工基础 §2氨合成的热力学基础 化学反应与反应热 0.5N2+1.5H2 NH3 £H 可逆、放热、体积缩小。 ·高压反应,气体显著偏离理想状态, ∴反应热不仅与温度有关,而且与压强、原料气组成、转化率等因 素有关。如:纯N,、H完全转化时 (H56.32 kJi fmol-NH ✉D☒?
§ 2 氨工业 热 学 础 合成的 力 基 一、化学反应与反应热 0.5 N2 + 1.5 H2 NH3 £ ¦ ¤H 可逆、放热、体积缩小。 ∵ 高压反应,气体显著偏离理想状态, ∴ 反应热不仅与温度有关,而且与压强、原料气组成、转化率等因 素有关。如:纯 N2 、 H2 完全转化时 (¦ ¤ H)¡ ¡ ¡ ¡ ¡ ¡ = £ 56.32 kJ¡ ñ mol-1NH3 300atm 500oC
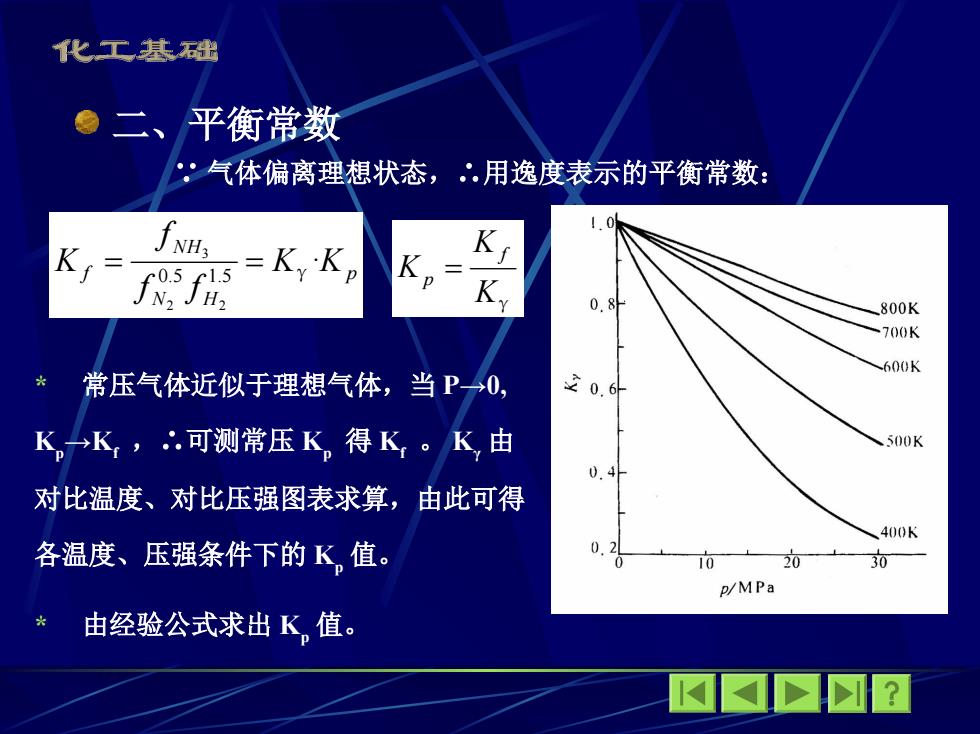
化工基础 二、平衡常数 ,气体偏离理想状态,.用逸度表示的平衡常数: fNH: Ky 0.8 800K 700K 600K 常压气体近似于理想气体,当P0, 20.6 K,→K,可测常压K,得K。K由 .500K 对比温度、对比压强图表求算,由此可得 400K 各温度、压强条件下的K值。 0 10 0 30 p/MPa 由经验公式求出K,值。 M网☒?
二、平衡常数 ∵ 气体偏离理想状态,∴用逸度表示的平衡常数: p N H NH f K K f f f K · 0.5 1.5 2 2 3 γ Kγ K K f p * 常压气体近似于理想气体,当 P→0, K p →Kf ,∴可测常压 K p 得 Kf 。 K γ 由 对比温度、对比压强图表求算,由此可得 各温度、压强条件下的 K p 值。 * 由经验公式求出 K p 值

化工基础 二、平衡影响因素(如何提高平衡氨的浓度?) 设: XNH XH2二 氢氮比 XNH;+XH+XN+xi=1 XNH:+IXN,+XN,+xi=1 1-XNH;-X1 XN2 r+1 PNH3 P.XNH: 1 XNH3 X NH3 0.51.5 PN2 PH2 (Px)5(Px,)5 Pr15(m-)2 r+1 X NH3 r15 =P.K 1-x,-x)2 (r+1)2 XNH3 时
二、平衡影响因素(如何提高平衡氨工业的浓度?) 设: r x x N H 2 2 —— 氢氮比 NH3 x H2 x N2 x i x x NH x H x N xi 1 3 2 2 1 1 3 2 r x x x NH i N x NH rx N x N xi 1 3 2 2 2 1 0.5 1.5 0.5 1.5 1.5 2 1.5 1 · ( ) · 1 ( ) ( ) · 3 3 2 3 2 2 3 2 2 3 r x x NH N NH N H NH N H NH p NH i P r x r x x Px Px P P x p p p K 2 1.5 2 (r 1) · · (1 ) 3 3 r P K x x x p NH i NH xNH3 ~ P 、 K p (T 、 P) 、 r 、 xi

化工基础 ·1、氢氮比r d 60 当T、P一定时, =0 100MPa dr (r+1)2 50 1.5r05 2 ro5.5r+1)-2r] 0 60MPa 40 (r+1)2 (+1)3 (r+1)3 30 30MPa 1.5(r+1)-2r=0 .r=3 20 10MPa 如:450℃,300atm下,r=2.92时,最大。 10 0 23 5 H2:N2 qP☒?
1 、氢氮比 r 当 T 、 P 一定时, 0 (r 1) r dr d 2 1.5 0 ( 1) 1.5( 1) 2 ( 1) 2· ( 1) 1.5· 3 0.5 3 1.5 2 0.5 r r r r r r r r 1.5 ( r + 1 ) - 2r = 0 ∴ r = 3 如: 450℃ , 300atm 下, r = 2.92 时,最大