
当解离平衡常数K很小,酸的 起始浓度c较大时, 则有c>c(H+),于是式 [c(H)]2 K= co-cH+) [c(H)]2 可简化成 K= Co
当解离平衡常数 K 很小,酸的 起始浓度 c0 较大时, 则有 c0 >> c(H+ ),于是式 Ka = c0- c (H+) [ c H+ ] ( )2 可简化成 Ka = c0 [ c H+ ] ( )2

K,-1c Co 所以c(Hf)=VKco 在一元弱酸体系中,其适用 条件为 Co>400 Ka
所以 c H+ = Ka c ( ) 0 在一元弱酸体系中,其适用 条件为 c0 > 400 Ka K a = c0 [ c H+ ] ( )2

氨水NHL3H,0的解离平衡可以 表示成 NH3H2ONH+OH 碱式解离的解离平衡常数用K6 表示,经常简写作Kb
氨水 NH3 •H2O 的解离平衡可以 表示成 NH3 •H2O NH4 + + OH- 碱式解离的解离平衡常数用 表示,经常简写作Kb。 K ⊖ b
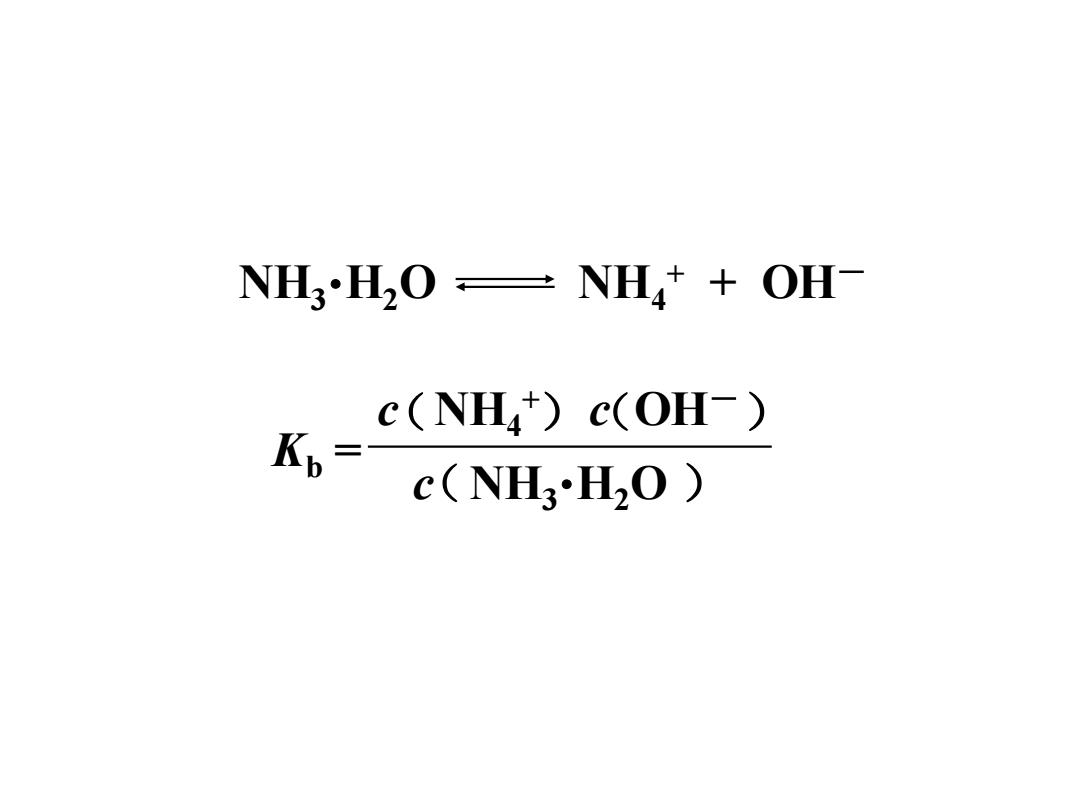
NHH2O一NH4+OH C(NH C(OH) K c(NH3H2O)
NH3 •H2O NH4 + + OH- Kb = c NH4 + ( )(c OH-) c(NH3 •H2O )

C(NH C(OH) Kp= C(NH3H2O) 若用c表示氨水溶液的起始 浓度,则有 Kp- [c(OH-)]2 o-c(OH-
若用 c0 表示氨水溶液的起始 浓度,则有 Kb = c NH4 + ( )(c OH-) c(NH3 •H2O ) Kb = c0- c (OH-) [ c OH- ] ( )2