
二 酸碱离解平衡 染弱酸、弱碱的离解常数 HA+H20÷H30++A 简写为:HA÷H+A K。= H+]·[A-J [HA] A+H,O÷HA+OH 常用弱酸、弱碱离解常数可查表 K。=[HA]-[OH] [A] 上一页 下一页 返回 退出
上一页 下一页 返回 退出 二、酸碱离解平衡 弱酸、弱碱的离解常数 常 用 弱 酸 、 弱 碱 离 解 常 数 可 查 表 返回 A- + H2O ⇌ HA +OH- [A ] [ ] [ ] − − = HA OH Kb HA + H2O ⇌ H3O++ A- 简写为: HA ⇌ H++ A- [ ] [ ] [A ] HA H Ka + − =
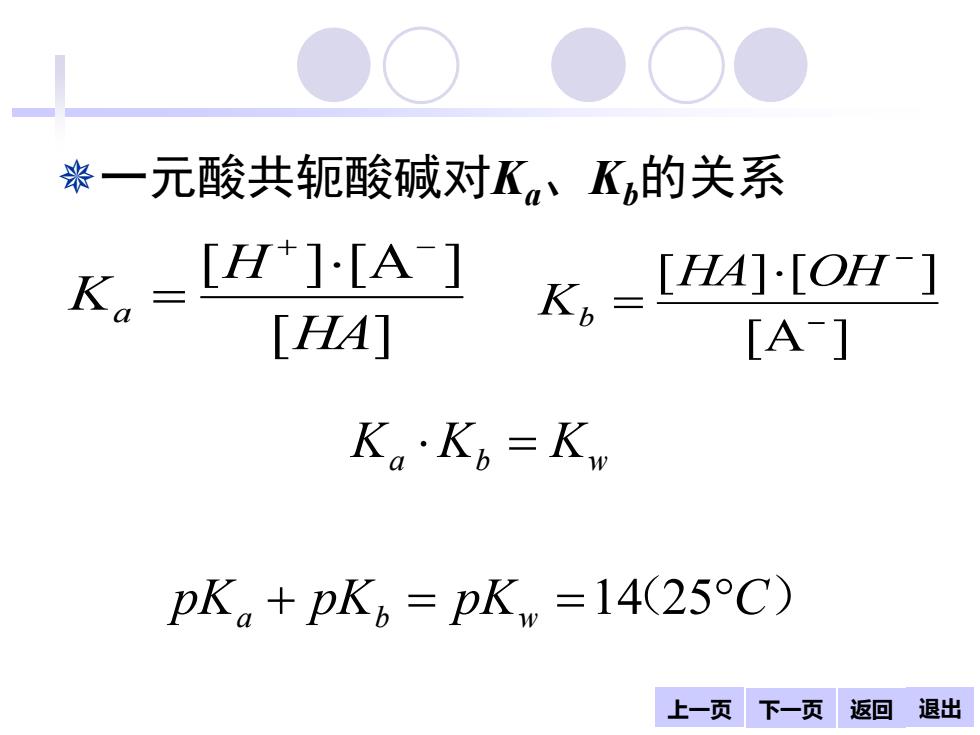
袅一元酸共轭酸碱对K、K的关系 K,=[H1-[A] K =[HA][OH-] [HA] [A] K。·Kb=K pK。+pK6=pKw=1425C) 上一页下一页 返回退出
上一页 下一页 返回 退出 一元酸共轭酸碱对Ka、Kb的关系 pK pK pK ( C) K K K a b w a b w + = = = 14 25 [A ] [ ] [ ] − − = HA OH Kb [ ] [ ] [A ] HA H Ka + − = 返回
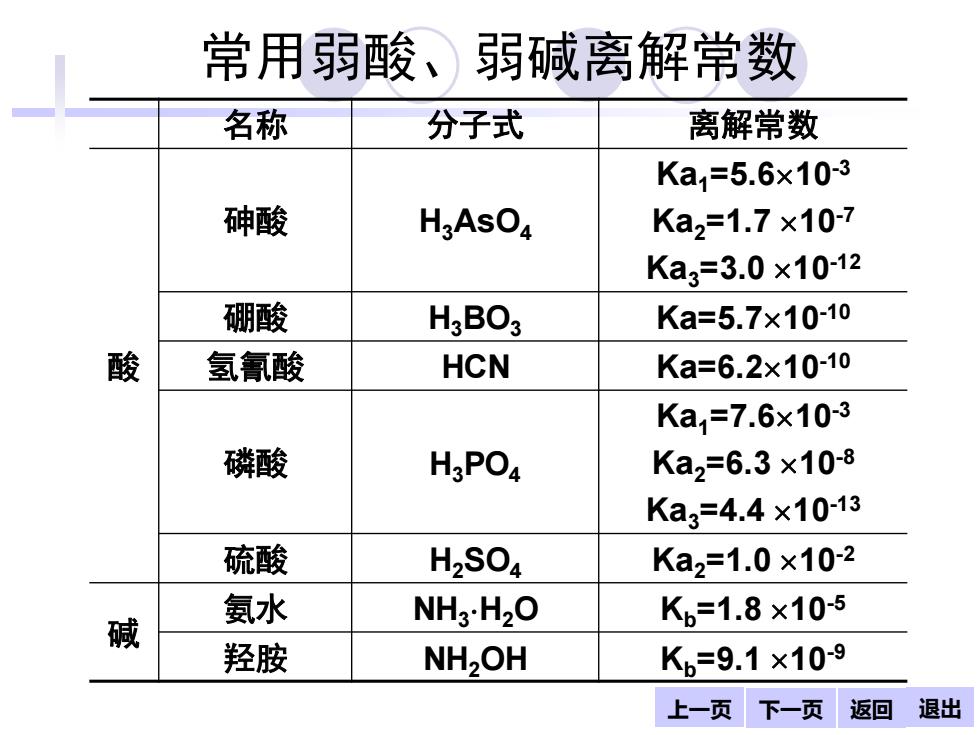
常用弱酸、弱碱离解常数 名称 分子式 离解常数 Ka=5.6x10-3 砷酸 HgAsO Ka2=1.7×10-7 Ka3=3.0×10-12 硼酸 H2BO3 Ka=5.7×10-10 酸 氢氰酸 HCN Ka=6.2×10-10 Ka=7.6x10-3 磷酸 H3PO Ka2=6.3×10-8 Ka3=4.4×10-13 硫酸 H2SO4 Ka2=1.0×10-2 氨水 NH3.H2O Kb=1.8×10-5 碱 羟胺 NH,OH Kb=9.1×10-9 上一页下一页返回退出
上一页 下一页 返回 退出 常用弱酸、弱碱离解常数 名称 分子式 离解常数 酸 砷酸 H3AsO4 Ka1=5.610-3 Ka2=1.7 10-7 Ka3=3.0 10-12 硼酸 H3BO3 Ka=5.710-10 氢氰酸 HCN Ka=6.210-10 磷酸 H3PO4 Ka1=7.610-3 Ka2=6.3 10-8 Ka3=4.4 10-13 硫酸 H2SO4 Ka2=1.0 10-2 碱 氨水 NH3 H2O Kb=1.8 10-5 羟胺 NH2OH Kb=9.1 10-9 返回
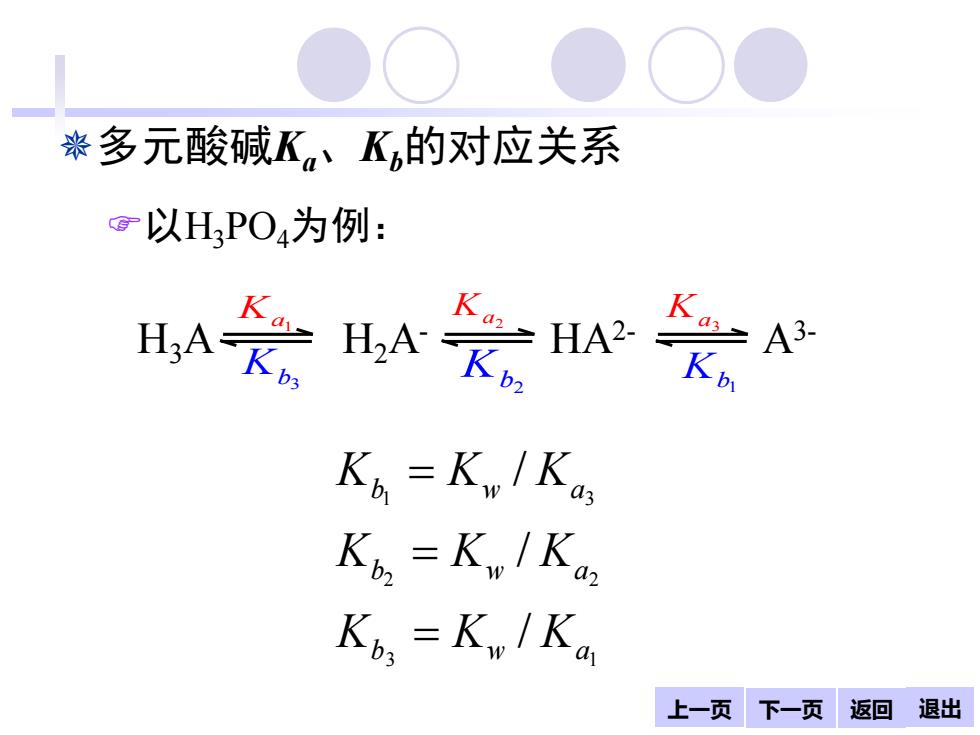
染多元酸碱K,、K的对应关系 g以HPO4为例: A会水会H K≥ A3- Kb=Kw/Kas Ko.=Kw/Ka Ko Kw/Ka 上一页下一页返回退出
上一页 下一页 返回 退出 多元酸碱Ka、Kb的对应关系 以H3PO4为例: 3 1 2 2 1 3 / / / b w a b w a b w a K K K K K K K K K = = = H3A H2A- HA2- A3- Ka1 a2 K a3 K b1 K b2 Kb3 K 返回

§4-2不同pH值溶液中酸碱存在形 式的分布情况一分布曲线 一、分析浓度和平衡浓度 二、酸度对酸碱溶液中各组分浓度的影响 1.一元酸 2.二元酸 3.n元酸 上一页下一页返回退出
上一页 下一页 返回 退出 §4-2 不同pH值溶液中酸碱存在形 式的分布情况-分布曲线 一、分析浓度和平衡浓度 二、酸度对酸碱溶液中各组分浓度的影响 1. 一元酸 2. 二元酸 3. n 元酸 返回