
两者之间有联系也有差别 ●与溶解度概念应用范围不同,X,°只用来表示难溶电解质的溶解度; ● ,°不受离子浓度的影响,而溶解度则不同。 ●用K,°比较难溶电解质的溶解性能只能在相同类型化合物之间进行, 溶解度则比较直观。 Example 2 若Ag,Cr0,的KD(Ag,Cr0,)=1.1×10-2,求其 在水中的溶解度。 Solution 1×10-卫 4 =6.5×10-3mol,L 11 上页下页 节首 节尾
11 两者之间有联系也有差别 ●与溶解度概念应用范围不同,Ksp θ只用来表示难溶电解质的溶解度; ● Ksp θ不受离子浓度的影响,而溶解度则不同。 ●用Ksp θ比较难溶电解质的溶解性能只能在相同类型化合物之间进行, 溶解度则比较直观。 Example 2 Solution 在水中的溶解度。 若Ag2CrO4的Ks θ p (Ag2CrO4 ) 1.110 12 ,求其 5 1 3 12 3 θ sp 6.5 10 mol L 4 1.1 10 4 K S

Example 3 AgC1和Ag2CrO,的溶度积分别为1.8×1010 和1.1×1012,则下面叙述中正确的是: (A)AgC1与Ag2CrO,的溶度度相等 (B)AgCI的溶解度大于Ag2CrO (C)二者类型不同,不能由K大小直接判断溶解度大小 Solution 经计算可知: 分子式 溶度积 溶解度/mol·dm-3 AgCl 1.8×10-10 1.3X10-5 AgBr 5.0×10-13 7.1×10-7 AgI 8.3×10-17 9.1×10-10 Ag2CrO. 1.1×10-12 6.5×10-5 结论: (1)相同类型 大的S也大 AgCl AgBr Agl 减小 :S减小 12 (2)不同类型的比较要通过计算说明. 上页下页节首节尾
12 (A) AgCl与Ag2CrO4的溶度度相等 (B) AgCl的溶解度大于Ag2CrO4 (C) 二者类型不同,不能由Ksp θ大小直接判断溶解度大小 Solution Example 3 AgCl 和 Ag2CrO4的溶度积分别为 1.8×10-10 和 1.1 ×10-12 ,则下面叙述中正确的是: 分子式 溶度积 溶解度/ AgBr AgI AgCl mol · dm-3 1.8×10 -10 Ag2CrO4 1.3×10 -5 5.0×10 -13 7.1×10 -7 8.3×10 -17 9.1×10 -10 1.1×10 -12 6.5×10 -5 经计算可知: 结论: (1)相同类型 大的 S 也大 减小 S 减小 (2) 不同类型的比较要通过计算说明. θ Ksp AgCl AgBr AgI θ Ksp
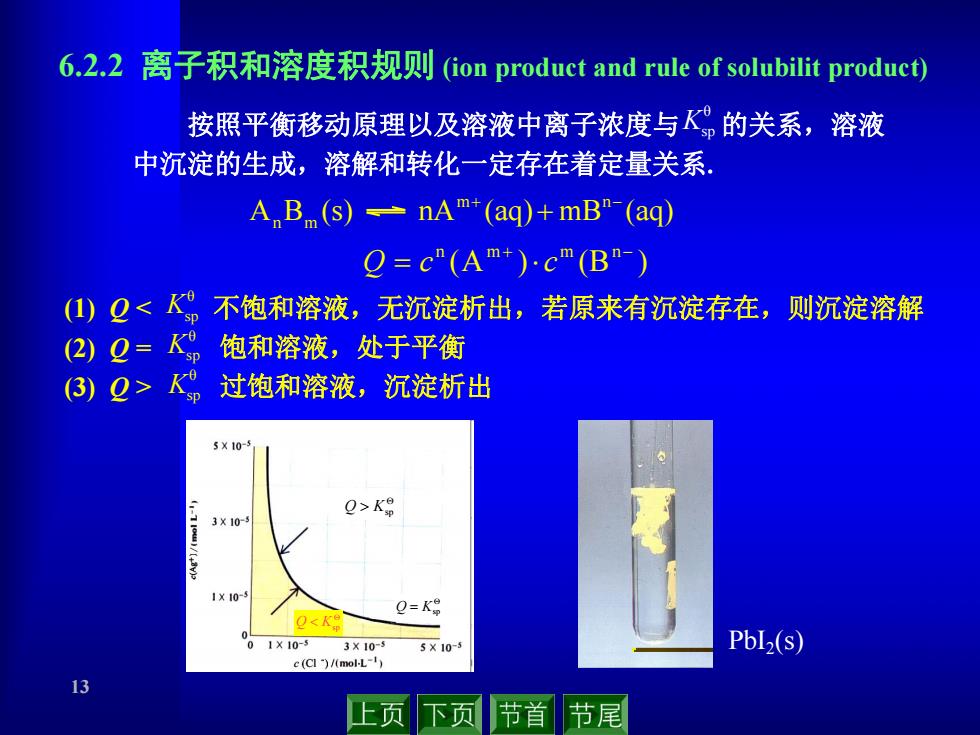
6.2.2离子积和溶度积规则(ion product and rule of solubilit product) 按照平衡移动原理以及溶液中离子浓度与的关系,溶液 中沉淀的生成,溶解和转化一定存在着定量关系. A B(s)=nA+(ag)+mB"-(ag) Q=c”(Am+)cm(Bn-) ()Q<人p不饱和溶液,无沉淀析出,若原来有沉淀存在,则沉淀溶解 (2)Q=KD饱和溶液,处于平衡 3)2>p 过饱和溶液,沉淀析出 5X10- Q>K 3X10 O=K9 0<K 1×10-5 3×10-3 5×10-5 Pbl2(s) c(CI)/(mol-L-1) 13 上页下页 节首节尾
13 (1) Q < 不饱和溶液,无沉淀析出,若原来有沉淀存在,则沉淀溶解 (2) Q = 饱和溶液,处于平衡 (3) Q > 过饱和溶液,沉淀析出 A B (s) nA (aq) mB (aq) m n n m (A ) (B ) n m m n Q c c 6.2.2 离子积和溶度积规则 (ion product and rule of solubilit product) 按照平衡移动原理以及溶液中离子浓度与 的关系,溶液 中沉淀的生成,溶解和转化一定存在着定量关系. θ Ksp θ Ksp θ Ksp θ Ksp Q Ksp Q Ksp Q Ksp PbI2(s)

你认为沉淀平衡中O和的关系与化 学平衡中浓度商和平衡常数的关系怎样? 14 上页下节首节尾
14 Question 1 你认为沉淀平衡中Q和 的关系与化 学平衡中浓度商和平衡常数的关系怎样? θ Ksp

Example 4 对已达到平衡的反应BaCO(s)=Ba2(aq)+CO(aq), 分别给其加入HCI、BaCl2或Na2CO3溶液,结果怎样? Solution ① 加酸 2H+C0→H,0+CO, (Co})↓Q↓Q<K利于BaCO3的溶解 ②加Ba2或CO cBa)个或c(C0)个Q↑2> 促使BaCO的生成 15 止页下页节首节尾
15 2 2 2 2H CO3 H OCO 利于 BaCO3 的溶解 ② 加 或 或 促使BaCO3的生成 2 Ba 2 CO3 θ sp 2 3 c(CO ) Q Q K (Ba ) 2 c θ sp 2 3 c(CO ) Q Q K 对已达到平衡的反应 , 分别给其加入HCl、BaCl2 或 Na2CO3 溶液,结果怎样? BaCO (s) Ba (aq) CO (aq) 2 3 2 3 Example 4 Solution ① 加酸