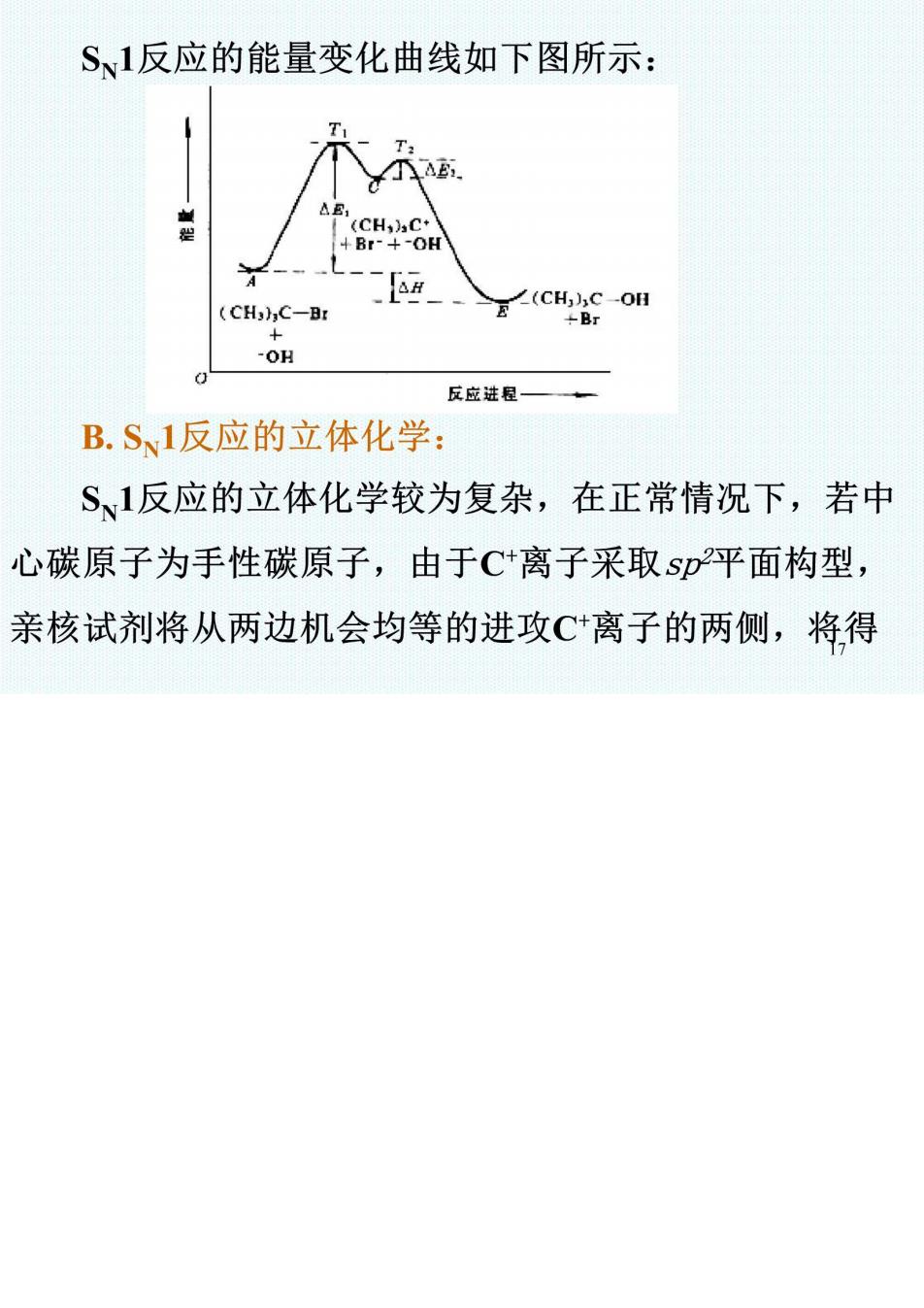
S、1反应的能量变化曲线如下图所示: (CHC+ 4Br-+-OH (CH3)C-Br E(cHSo阳 -OH 反应进程— B.S1反应的立体化学: S、1反应的立体化学较为复杂,在正常情况下,若中 心碳原子为手性碳原子,由于C+离子采取sp平面构型, 亲核试剂将从两边机会均等的进攻C离子的两侧,将得

到外消旋化合物。 然而,100%的外消旋化是很少 见的,经常是外消旋化伴随着构型反 转,且构型反转要多些。 Nu: H 、 CH,wCOH+HO CH C.Hs C.Hs C.S1反应的另一个特点—重排: 由于反应中包含有碳正离子中间体的生成,可以预 料,它将显示出碳正离子反应的特性。 如:2,2-二甲基-3-溴丁烷的醇解:

CH3 CH3 C-cr CH C (6) C2HsOH CH3Br CH:OC,Hs CH3 CH3 C2HsQ CH3 c42acH4cmcm器cl--- C2H OH (S1) CH3 CH3 CH3 2碳正离子 3°碳正离子 3.分子内亲核取代反应机理一邻基效应 当亲核试剂与离去基团处于同一分子内时,能否发 生分子内的亲核取代?回答是肯定的,可以。但这是有 条件的。以氯乙醇为例: CI OH 0

该反应得以进行的有利条件是:分子内的氧负离子距中 心碳原子的距离最近,且处于反式共平面的有利位置, 从而有利于从C原子的背后进攻中心碳原子。 这是一种分子内的S、2反应。象这种同一分子内, 个基团参与并制约与反应中心相连的另一个基团所发生 的反应,称为邻基参与。它是分子内基团之间的特殊作 用产生的影响,又称邻基效应。 邻基参与在加成反应、消除反应等反应中也普遍存 在,他在有机化学中也是研究较为活跃的内容之一。 三、影响亲核取代反应的因素

卤代烷的亲核取代反应,既可按S、1历程进行,也可 按S2历程进行,究竟按哪种机制进行,与卤代烷的结构、 亲核试剂、离去基团及溶剂等诸多因素有关。现分别讨 论之。 1.烃基结构的影响 A.对S2反应的影响: 如前所述:S、2反应的特点是亲核试剂从C一X键的 背后接近反应中心碳原子的,显然,α-碳上连有的烃基 ↑,亲核试剂越难以接近反应中心,其反应速率必然↓。 因此,在S、2反应中,卤代烷的活性次序应该是: 21