下面列出了硬酸、硬碱、软酸、软碱以及交界酸碱的一些例子。 酸 硬酸 交界酸 软酸 Ht,Li,Na,KtRb+,Cs力 Fe2+,Co2+,Ni2+,Cu2+,Zn2+ Co(CN)s,Pd2+,Pt2+,Pt+ Be2+,BeMe2,Mg2+,Ca2+,Sr2+(Ba2) Rh3+,r3+,R3+,Os2+ Cu*,Ag*,Au+,Cd2+,Hgz2+,Hg2+, Se3,La,Ce3+,Gd+,Lu,Th,U4, BMe3,GaH3 HgMe+ U0,2+,Pu+ R3C+,CoHs+,Sn2+,Pb2+ BH3,GaMe3,GaCl3,GaBr3, Ti,Zr4,Hr,vo2,Cr,Cr, NO+,Sb3+,Bi3+ Gal3,TI+,TiMe3 Mo03+,W0+,Mn2+,Mn7+,Fe3+,Co3+ CH2(卡宾) BF3,BCl3,B(OR)3,AIMe3,AICl3,AIH3, HO+,RO+,RS+,RSe+,Te+, Ga3+,n3+ RTe+ COz,RCO+,NC+,Si+,Sn+,SnMe3+, Br2,Br+,l2,I,ICN等 SnMez2+ O,CL,Br,I,N,RO,RO2 N3+,RPO2+,ROPO2*,As3+ M(金属原子和大块金属) S0,C7+,+,7+ K(键合氢的分子) 碱 硬碱 交界碱 软碱 NH3,RNH2,N2H CoHsNH2,CsHsN,N3,N2 H H20,0H,02,R0H,R0,R20 N02,S032 R,C2H4,CoH6,CN,RNC,CO CH3C00,C02,S02,P043,N03, Br SCN ,R3P,(RO)3P,R3As C104, R2S,RSH,RS,S2O,2- F,CI
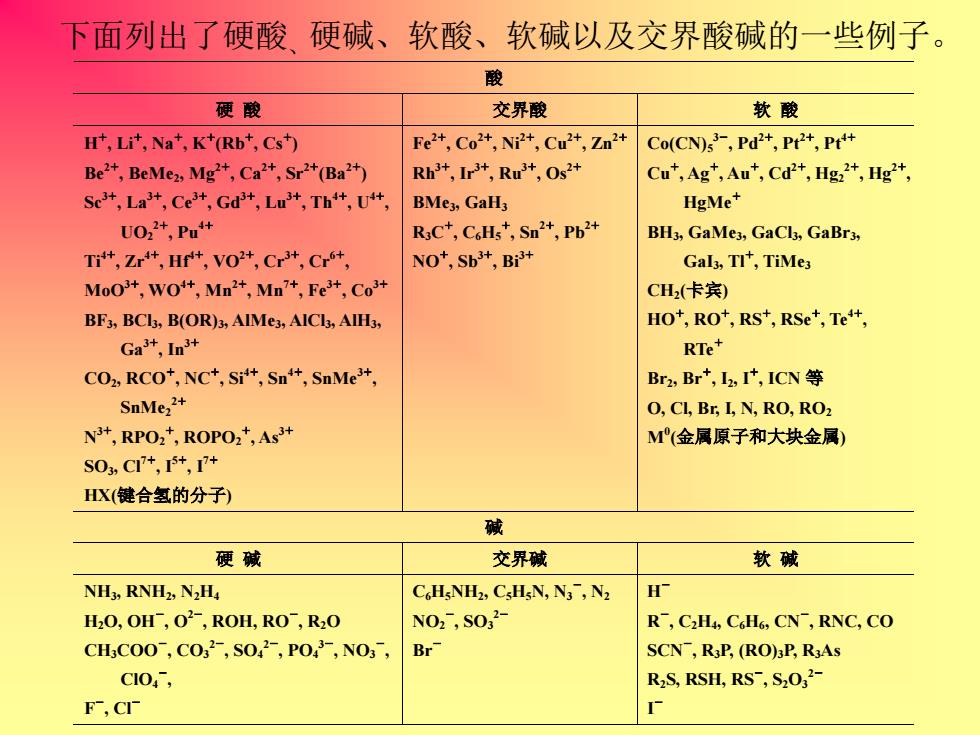
下面列出了硬酸、硬碱、软酸、软碱以及交界酸碱的一些例子。 酸 硬 酸 交界酸 软 酸 H + , Li+ , Na+ , K+ (Rb+ , Cs+ ) Be2+ , BeMe2, Mg2+ , Ca2+ , Sr2+ (Ba2+ ) Sc3+ , La3+ , Ce3+ , Gd3+ , Lu3+ , Th4+ , U4+ , UO2 2+ , Pu4+ Ti4+ , Zr4+ , Hf4+ , VO2+ , Cr3+ , Cr6+ , MoO3+ , WO4+ , Mn2+ , Mn7+ , Fe3+ , Co3+ BF3, BCl3, B(OR)3, AlMe3, AlCl3, AlH3, Ga3+ , In 3+ CO2, RCO+ , NC+ , Si4+ , Sn4+ , SnMe3+ , SnMe2 2+ N 3+ , RPO2 + , ROPO2 + , As3+ SO3, Cl7+ , I5+ , I7+ HX(键合氢的分子) Fe2+ , Co2+ , Ni2+ , Cu2+ , Zn2+ Rh3+ , Ir3+ , Ru3+ , Os2+ BMe3, GaH3 R3C + , C6H5 + , Sn2+ , Pb2+ NO+ , Sb3+ , Bi3+ Co(CN)5 3- , Pd2+ , Pt2+ , Pt4+ Cu+ , Ag+ , Au+ , Cd2+ , Hg2 2+ , Hg2+ , HgMe+ BH3, GaMe3, GaCl3, GaBr3, GaI3, Tl+ , TiMe3 CH2 (卡宾) HO+ , RO+ , RS+ , RSe+ , Te4+ , RTe+ Br2, Br+ , I2, I+ , ICN 等 O, Cl, Br, I, N, RO, RO2 M0 (金属原子和大块金属) 碱 硬 碱 交界碱 软 碱 NH3, RNH2, N2H4 H2O, OH- , O 2- , ROH, RO- , R2O CH3COO- , CO3 2- , SO4 2- , PO4 3- , NO3 - , ClO4 - , F - , Cl- C6H5NH2, C5H5N, N3 - , N2 NO2 - , SO3 2- Br- H - R - , C2H4, C6H6, CN- , RNC, CO SCN- , R3P, (RO)3P, R3As R2S, RSH, RS- , S2O3 2- I -

在反应时,硬酸和硬碱比硬酸与软碱更易结合形成 加合物,而软酸和软碱比软酸和硬碱或硬酸和软碱更易 结合形成加合物。 简单地说,硬酸易于与硬碱结合,软酸易与软碱结 合,或 硬一硬、软一软结合比硬一软(软一硬)结合稳定。 或叫 硬亲硬,软亲软,软硬交界就不管。 这被称作软一硬酸碱原理
在反应时,硬酸和硬碱比硬酸与软碱更易结合形成 加合物,而软酸和软碱比软酸和硬碱或硬酸和软碱更易 结合形成加合物。 简单地说,硬酸易于与硬碱结合,软酸易与软碱结 合,或 硬-硬、软-软结合比硬-软(软-硬)结合稳定。 或叫 硬亲硬,软亲软,软硬交界就不管。 这被称作软-硬酸碱原理

对于软一硬酸碱规则的初步解释是在1968年,由 Klopma基于多电子微扰理论对路易斯酸碱的前线分子 轨道(酸为最低未占据分子轨道,碱为最高占有分子轨 道)的能量进行计算得到反应的总微扰能,并根据静电 作用与共价作用相对大小作出的。 一般说来,硬酸趋向于形成离子键,因而易于与具 有较大电负性的配位原子的配体(硬碱)键合;而软酸趋 向于形成共价键,因而易于与有较小电负性的配位原子 的配体(软碱)键合。 有了这个原理前面出现的颠倒现象就容易合理地 解释了: A3+离子是一种硬酸,因此更易与硬碱如F一成键, 而Hg2+离子是一种软酸,因此就易与软碱如I-成键
有了这个原理前面出现的颠倒现象就容易合理地 解释了: Al3+离子是一种硬酸, 因此更易与硬碱如F-成键, 而Hg2+离子是一种软酸,因此就易与软碱如I-成键。 对于软-硬酸碱规则的初步解释是在1968年,由 Klopma基于多电子微扰理论对路易斯酸碱的前线分子 轨道(酸为最低未占据分子轨道,碱为最高占有分子轨 道)的能量进行计算得到反应的总微扰能,并根据静电 作用与共价作用相对大小作出的。 一般说来,硬酸趋向于形成离子键,因而易于与具 有较大电负性的配位原子的配体(硬碱)键合;而软酸趋 向于形成共价键,因而易于与有较小电负性的配位原子 的配体(软碱)键合

软硬酸碱原则在无机化学中有许多定性的应用: ●由于一种元素的硬度通常随着其氧化态的增大 而增大,氧化态越高硬度越大。因此,为了使一种处 于高氧化态的元素稳定,就必须使之与硬碱如O2、 OH-或F-配位:如F(VI)和PtV)这样的高价态能够 分别在化合物K,FeO4和PF6中得到。相反,为了使 种元素处于低氧化态,则必须用软碱如CO或PR,与元 素配位。如Na[Co-1(CO)4]和Pt[P(CH3)3l4这样的化合 物中可以见到Co(一1)和P(0)
●由于一种元素的硬度通常随着其氧化态的增大 而增大,氧化态越高硬度越大。因此,为了使一种处 于高氧化态的元素稳定,就必须使之与硬碱如O2-、 OH-或F-配位:如Fe(VI)和Pt(VI)这样的高价态能够 分别在化合物K2FeO4和PtF6中得到。相反,为了使一 种元素处于低氧化态,则必须用软碱如CO或PR3与元 素配位。如Na[Co-1 (CO)4 ]和Pt0 [P(CH3 )3 ]4这样的化合 物中可以见到Co(-1)和Pt(0)。 软硬酸碱原则在无机化学中有许多定性的应用:

●软硬酸碱原理还用来判断离子性盐在水中的溶 解度。 例如,L+是一种硬酸,HO分子、F一离子为硬 碱,且硬度次序是F->HO,因而L+与F一结合稳定 ,在水中溶解度小,但遇到软性较大的CI一、Br一、I 时,L+趋向于与HO结合,所以LiCI、LBr、L在水 中溶解度较大,且四种Lⅸ随着卤离子软性的增加而 溶解度逐渐增大。相反,Ag+离子是一种软酸,它趋 向于与软碱结合。所以随着卤离子半径增加,软度增 大,溶解度减小
●软硬酸碱原理还用来判断离子性盐在水中的溶 解度。 例如,Li+是一种硬酸,H2O分子、F-离子为硬 碱,且硬度次序是F->H2O,因而Li+与F-结合稳定 ,在水中溶解度小,但遇到软性较大的Cl-、Br-、I- 时,Li+趋向于与H2O结合,所以LiCl、LiBr、LiI在水 中溶解度较大,且四种LiX随着卤离子软性的增加而 溶解度逐渐增大。相反,Ag+离子是一种软酸,它趋 向于与软碱结合。所以随着卤离子半径增加,软度增 大,溶解度减小