
第四章 酸碱滴定法 4.1概述 4.2水溶液中的酸碱平衡 4.3酸碱指示剂 4.4酸碱滴定法的基本原理 4.5滴定终点误差 4.6应用与示例
第四章 酸碱滴定法 4.1概述 4.2水溶液中的酸碱平衡 4.3酸碱指示剂 4.4酸碱滴定法的基本原理 4.5滴定终点误差 4.6应用与示例

4.1概述 酸碱滴定法(acid-base titration):以酸 碱反应为基础的滴定分析法。 应用的对象:酸、碱以及能与酸、碱反 应的物质
4.1 概述 酸碱滴定法(acid-base titration):以酸 碱反应为基础的滴定分析法。 应用的对象:酸、碱以及能与酸、碱反 应的物质
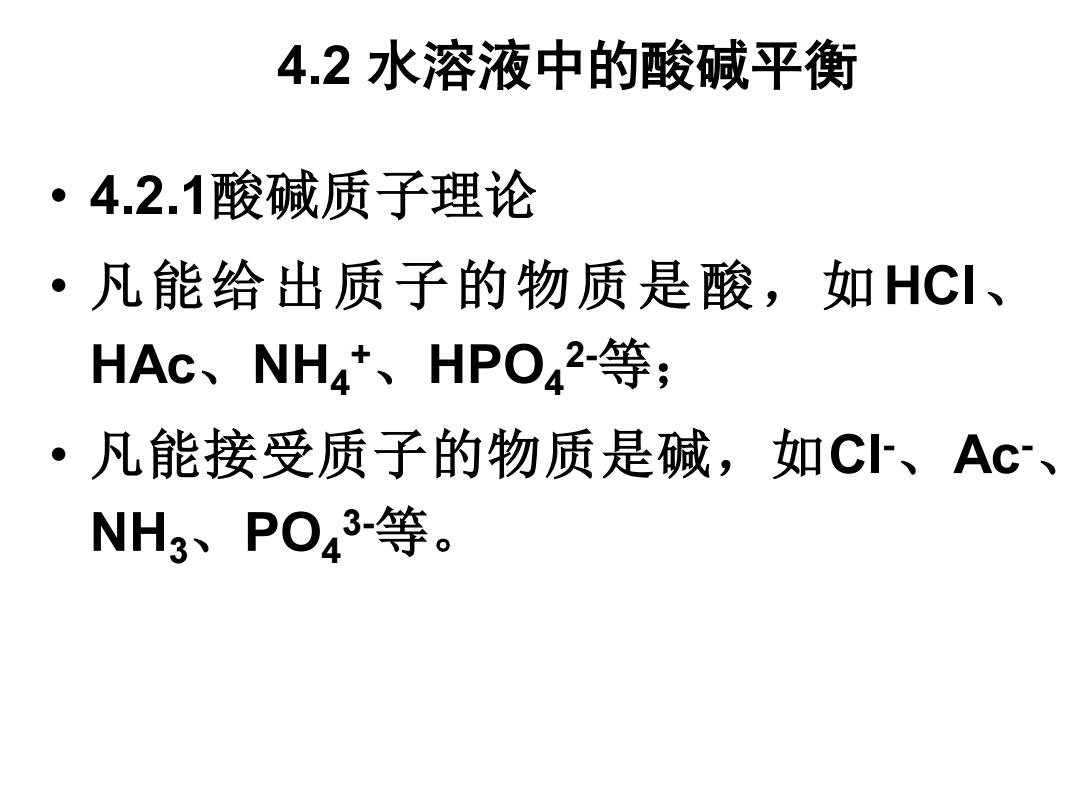
4.2水溶液中的酸碱平衡 ·4.2.1酸碱质子理论 ·凡能给出质子的物质是酸,如HCI、 HAc、NH4、HPO,2等; ·凡能接受质子的物质是碱,如C、Ac、 NH3、PO43-等
4.2 水溶液中的酸碱平衡 • 4.2.1酸碱质子理论 • 凡能给出质子的物质是酸,如HCl、 HAc、NH4 + 、HPO4 2-等; • 凡能接受质子的物质是碱,如Cl-、Ac-、 NH3、PO4 3-等

·酸失去质子后变成相应的共轭碱;而碱 接受质子后变成相应的共轭酸。 HA→A+H 酸碱质子 HA-A称为共轭酸威对
• 酸失去质子后变成相应的共轭碱;而碱 接受质子后变成相应的共轭酸。 酸 碱 质子 HA-A-称为共轭酸碱对 − + HA→ A + H
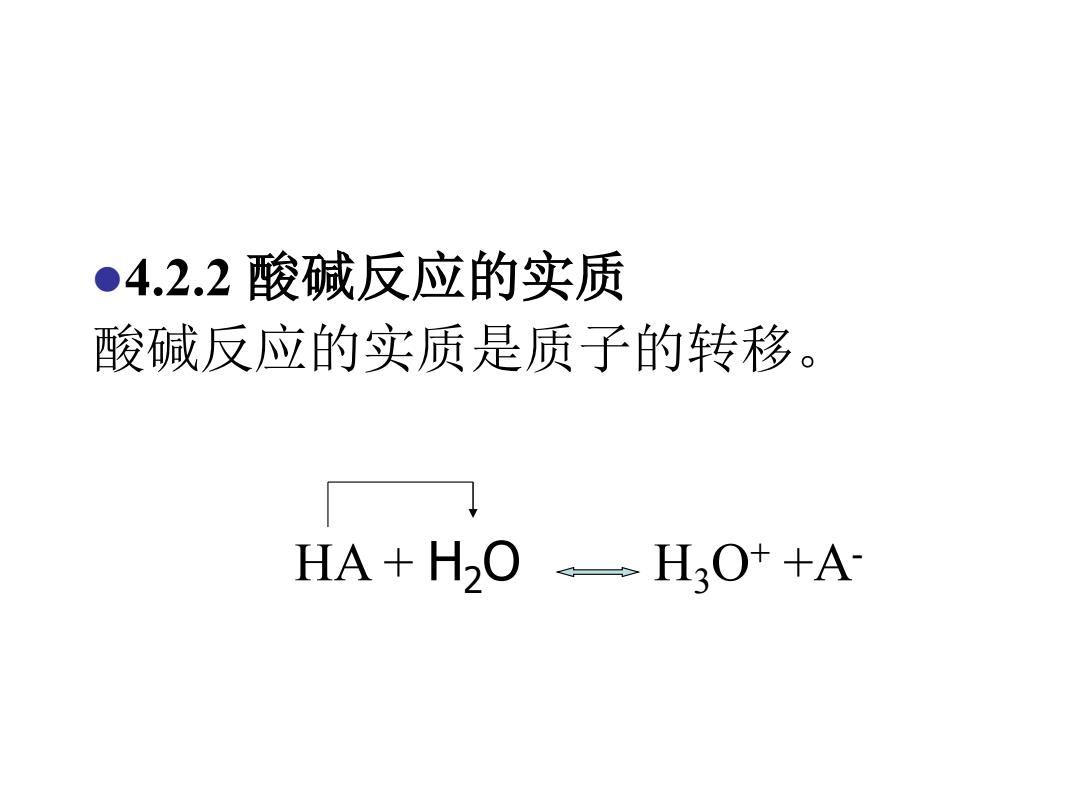
●4.2.2酸碱反应的实质 酸碱反应的实质是质子的转移。 HA+HO。H3O++A
⚫4.2.2 酸碱反应的实质 酸碱反应的实质是质子的转移。 HA + H2O H3O+ +A-