
如: Pt,H2(101325PaH+(au+=1))ICu2+(xmol/I)Cu 电池电动势: E电池=P右-P左=Pcu电极一PH电极 若:[Cu2+]=1mol/M,则 Pcu电极=Pcu电极 25°℃时,该电池的电动势为+0.344V, 即, E电池=Pc电极=+0.344V
如: Pt,H2 (101325Pa|H+ (αH+=1))||Cu2+(xmol/l)|Cu 电池电动势: 若:[Cu2+]=1mol/l ,则 25℃时,该电池的电动势为+0.344V, 即, E电池 = 右 − 左 = Cu电极 − H电极 − Cu电极 = Cu电极 E = Cu = +0.344V − 电池 电极
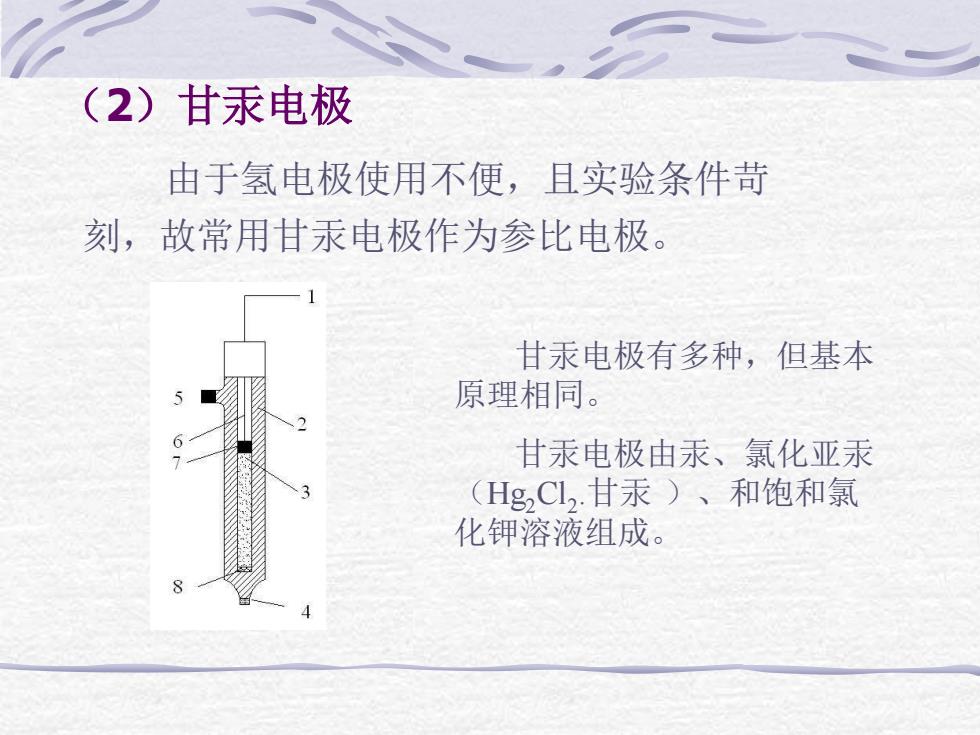
(2)甘汞电极 由于氢电极使用不便,且实验条件苛 刻,故常用甘汞电极作为参比电极。 甘汞电极有多种,但基本 原理相同。 甘汞电极由汞、氯化亚汞 (HgC12.甘汞)、和饱和氯 化钾溶液组成
(2)甘汞电极 由于氢电极使用不便,且实验条件苛 刻,故常用甘汞电极作为参比电极。 甘汞电极有多种,但基本 原理相同。 甘汞电极由汞、氯化亚汞 (Hg2Cl2 .甘汞 )、和饱和氯 化钾溶液组成

电极反应如下: Hg,Cl,(S)+2e=2Hg+2Cl 能斯特公式为: =mci2(IC1) 2 =0g,c,1Hg-0.059log[C1]/1mol*11) 由上式可见,甘汞电极的电位取决于所用 KCI的浓度
电极反应如下: Hg2Cl2(S)+2e=2Hg+2Cl- 能斯特公式为: 由上式可见,甘汞电极的电位取决于所用 KCl的浓度。 0.059log[ ]/(1 * ) ) 1 * [ ] ( 1 log 2 0.059 1 / 2 1 / 2 2 2 2 − − − − − − = − = + Cl mol l mol l Cl H g Cl H g H g Cl H g

(3)标准电极 Ag-AgCI电极,由一个插入已用AgCI饱 和了的KCI溶液中的Ag电极构成:AgCI(饱 和),KCI(xF)Ag电极反应为: AgCl+e=Ag+Cl 04gC14g=0.222V/ 与甘汞电极相同,其电极电位取决于C 的浓度
(3)标准电极 Ag-AgCl电极,由一个插入已用AgCl饱 和了的KCl溶液中的Ag电极构成:AgCl(饱 和),KCl(xF)|Ag电极反应为: AgCl+e=Ag+Cl- 与甘汞电极相同,其电极电位取决于Cl- 的浓度。 AgCl / Ag = 0.222V −

4、电极的极化 若一电极的电极反应可逆,通过电极的电流非 常小,电极反应在平衡电位下进行该电极称为可逆 电极。如Ag IAgCI等都可近似为可逆电极。 只有可逆电极才满足能斯特方程。 当较大电流通过电池时,电极电位将偏离可逆 电位,不在满足能斯特方程,电极电位改变很大, 而电流变化很小,这种现象称为电极极化。电池的 两个电极均可发生极化
4、电极的极化 若一电极的电极反应可逆,通过电极的电流非 常小,电极反应在平衡电位下进行该电极称为可逆 电极。如Ag|AgCl等都可近似为可逆电极。 只有可逆电极才满足能斯特方程。 当较大电流通过电池时,电极电位将偏离可逆 电位,不在满足能斯特方程,电极电位改变很大, 而电流变化很小,这种现象称为电极极化。电池的 两个电极均可发生极化