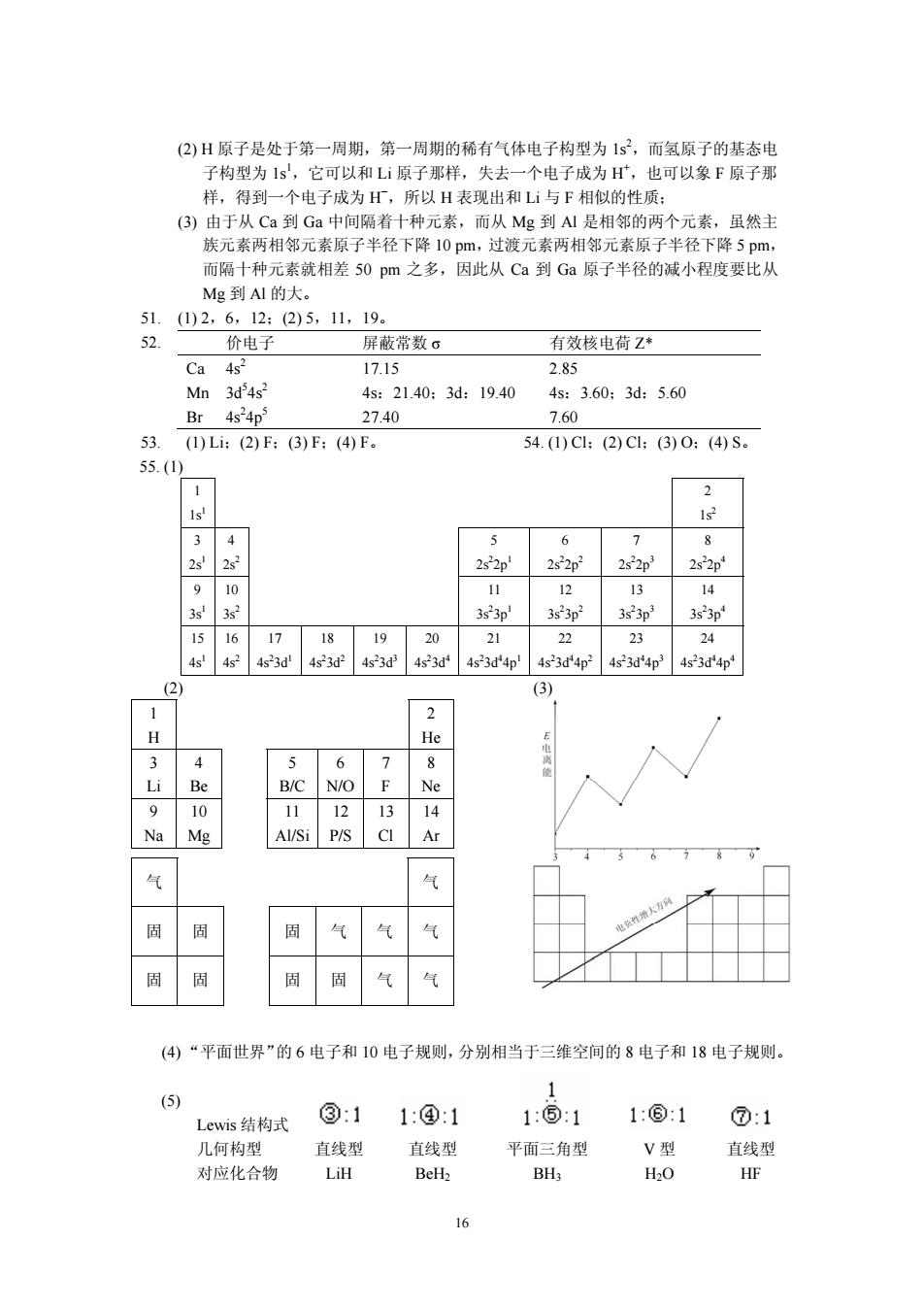
(2)H原子是处于第一周期,第一周期的稀有气体电子构型为1s2,而氢原子的基态电 子构型为1s,它可以和L原子那样,失去一个电子成为,也可以象F原子那 样,得到一个电子成为,所以日表现出和与F相似的性质 ()由于从Ca到Ga中间隔着十种元素,而从Mg到A1是相邻的两个元素,虽然主 族元素两相邻元素原子半径下降10pm,过渡元素两相邻元素原子半径下降5pm, 而隔十种元素就相差50pm之多,因此从Ca到Ga原子半径的减小程度要比从 Mg到AI的大 5102,6,12:25.,19 价电子 屏蔽常数G 有效核电荷Z* Ca 4s2 17.15 285 Mn 3d4s? 4s:2140:3d:19.40 4s:3.60:3d:5.60 Br 4s4p 27.40 7.60 53.(1)Li:(2)F:(3)F;(4)F. 54.()C1:(2)C1:(3)0:(4)S。 55.(1) 1 2 1s 2522p3 2s2p' 910 11 12 13 14 3s3s2 323n1 3523p23523p33s3p 20 4s34p 4523对4p24523d4p4523d4p 2 (3) 1 2 H 6 7 名 N/O 8 9 11 12 Mg Al/Si P/S CI 568 气 气 2 固 气 (4“平面世界”的6电子和10电子规则,分别相当于三维空间的8电子和18电子规则。 Lewis结构式 ③:1 1:④1 1:⑤:1 1:⑥:1 ⑦:1 几何构型 直线型 平面三角型 对应化合物 直线型 BH
16 55. (1) 1 2 1s1 1s2 3 4 5 6 7 8 2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 9 10 11 12 13 14 3s1 3s2 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 15 16 17 18 19 20 21 22 23 24 4s1 4s2 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d4 4s2 3d4 4p1 4s2 3d4 4p2 4s2 3d4 4p3 4s2 3d4 4p4 (2) (3) 1 2 H He 3 4 5 6 7 8 Li Be B/C N/O F Ne 9 10 11 12 13 14 Na Mg Al/Si P/S Cl Ar 气 气 固 固 固 气 气 气 固 固 固 固 气 气 (4) “平面世界”的 6 电子和 10 电子规则,分别相当于三维空间的 8 电子和 18 电子规则。 (5) Lewis 结构式 几何构型 直线型 直线型 平面三角型 V 型 直线型 对应化合物 LiH BeH2 BH3 H2O HF (2) H 原子是处于第一周期,第一周期的稀有气体电子构型为 1s2 ,而氢原子的基态电 子构型为 1s1 ,它可以和 Li 原子那样,失去一个电子成为 H+ ,也可以象 F 原子那 样,得到一个电子成为 H− ,所以 H 表现出和 Li 与 F 相似的性质; (3) 由于从 Ca 到 Ga 中间隔着十种元素,而从 Mg 到 Al 是相邻的两个元素,虽然主 族元素两相邻元素原子半径下降 10 pm,过渡元素两相邻元素原子半径下降 5 pm, 而隔十种元素就相差 50 pm 之多,因此从 Ca 到 Ga 原子半径的减小程度要比从 Mg 到 Al 的大。 51. (1) 2,6,12;(2) 5,11,19。 52. 价电子 屏蔽常数 σ 有效核电荷 Z* Ca 4s2 17.15 2.85 Mn 3d5 4s2 4s:21.40;3d:19.40 4s:3.60;3d:5.60 Br 4s2 4p5 27.40 7.60 53. (1) Li;(2) F;(3) F;(4) F。 54. (1) Cl;(2) Cl;(3) O;(4) S
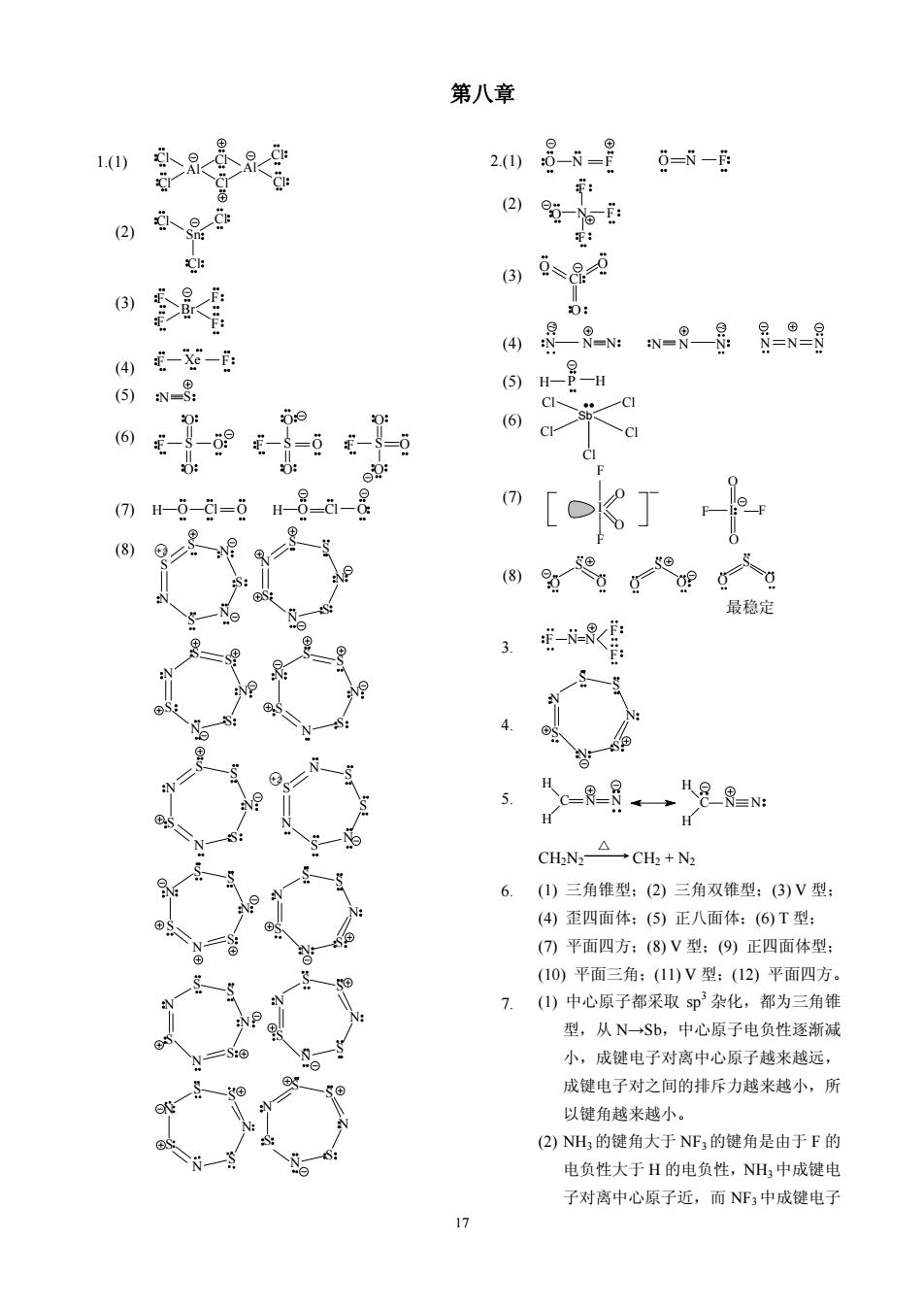
第八章 208-s-目 6=N- (2)5一。 6)g、89 0登骨 0: ④年-花-年 ④是R-:w-8是8=8=目 =-6 (6)cr c ()H-0-9=6 H8d-是 [o 最稳定 3. f-营 N 5. cR=8→足R阳 H CN△CH+N 6.()三角锥型:(2)三角双锥型:(3)V型: (4)歪四面体:(⑤)正八面体:(6T型: (7)平面四方:(8)V型:(9)正四面体型 (10)平面三角:(1)V型:(12)平面四方。 7.(1)中心原子都采取5p3杂化,都为三角锥 型,从N→Sb,中心原子电负性逐渐减 小,成键电子对离中心原子越来越远, 成键电子对之间的排斥力越来越小,所 以键角越来越小。 (2)NH的键角大于NF;的键角是由于F的 电负性大于H的电负性,NH中成键电 子对离中心原子近,而NF3中成键电子
17 第八章 1.(1) Al Al Cl Cl Cl Cl Cl Cl (2) Cl Cl Cl Sn (3) Br F F F F (4) (5) F Xe F N S (6) O F O O S O F O O S O F O O S (7) H O Cl O H O Cl O (8) S N S N S N S N S N S N S S N S N S N S S N S N S N S S N S N S N S S S N S N S S N N S N S N S S N S N S N S S N S N S N S S N S N S N S S N S N S N S S N S N S N S S 2.(1) O N F O N F (2) F O F F N (3) O O O Cl (4) N N N N N N N N N 2 2 (5) H P H (6) Sb Cl Cl Cl Cl Cl (7) I F F O O F I F O O (8) O O O O S S O O S 最稳定 3. F N=N F F 4. N S N S N S S 5. H C H N N H C H N N CH2N2 △ CH2 + N2 6. (1) 三角锥型;(2) 三角双锥型;(3) V 型; (4) 歪四面体;(5) 正八面体;(6) T 型; (7) 平面四方;(8) V 型;(9) 正四面体型; (10) 平面三角;(11) V 型;(12) 平面四方。 7. (1) 中心原子都采取 sp 3 杂化,都为三角锥 型,从 N→Sb,中心原子电负性逐渐减 小,成键电子对离中心原子越来越远, 成键电子对之间的排斥力越来越小,所 以键角越来越小。 (2) NH3 的键角大于 NF3 的键角是由于 F 的 电负性大于 H 的电负性,NH3 中成键电 子对离中心原子近,而 NF3中成键电子
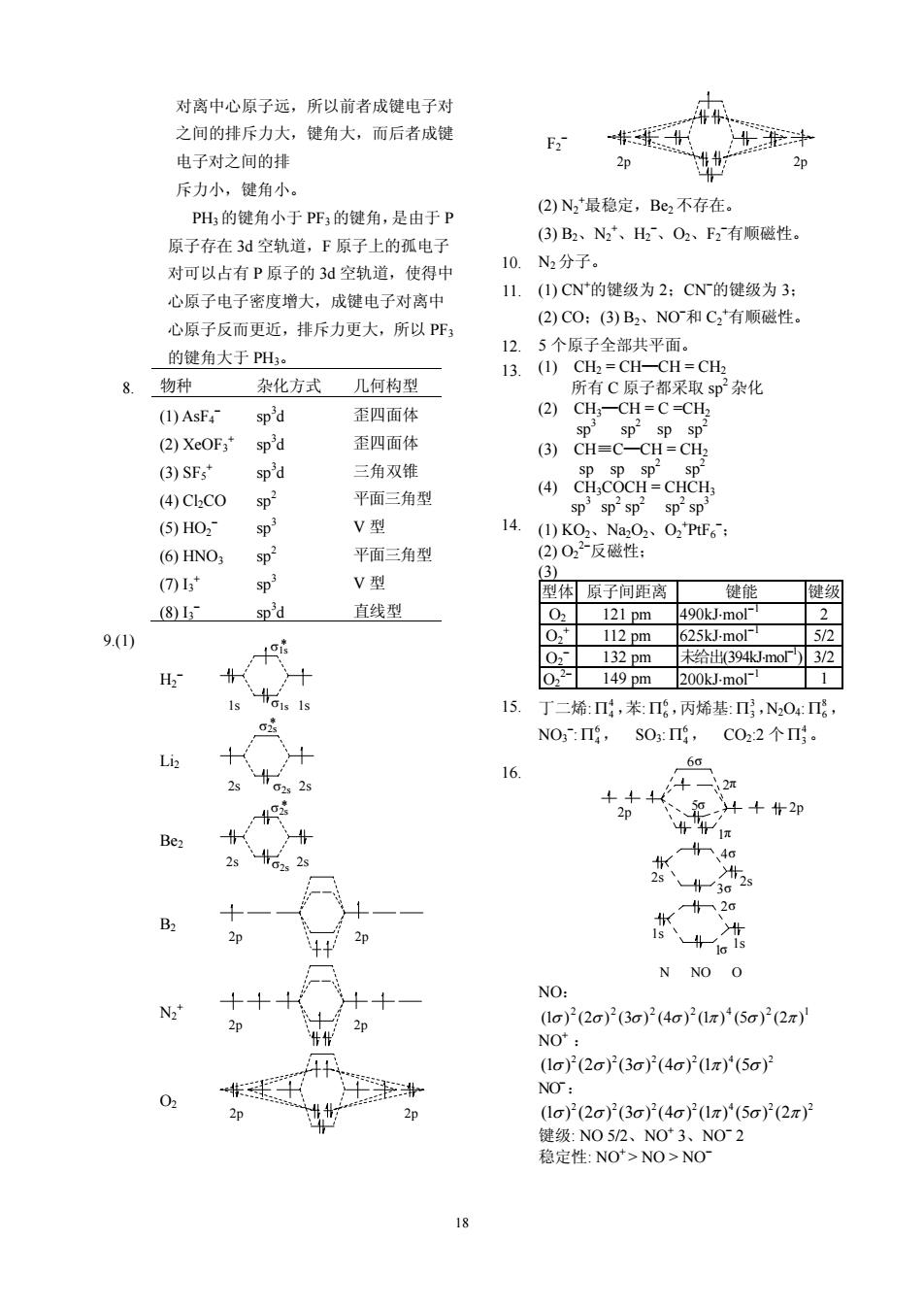
对离中心原子远,所以前者成健电子对 之间的排斥力大,健角大,而后者成键 .传日 电子对之间的排 斥力小,键角小 PH,的键角小于PF的键角,是由于P (2)N最稳定,Be,不存在 原子在在3d空轨道,F原子上的氟申子 (3)B2、N、H、O2、F2有顺磁性。 对可以占有P原子的3d空轨道,使得中 10.N2分子 心原子电子密度增大,成键电子对离中 11.(1)CN的键级为2:CN的键级为3: 心原子反而更近,排斥力更大,所以PF (2)CO:(3)B2、NO和C,有顺磁性 的链角大于PH 12.5个原子全部共平面。 13.(1)CH2=CH-CH=CH2 8.物种 杂化方式几何构型 所有C原子都采取s即杂化 (1)AsF- sp'd 歪四面体 (2)CH-CH=C=CH (2)XeOF, sp'd 歪四面体 (3)SFs 三角双锥 (4)C2C0 、 平面三角型 sp sp (6)HO, sp V型 14. (6)HNO: 平面三角型 V型 型体原子间距离 键能 健级 (8)13 sp'd 直线型 0 121pm 400k Lmol- 9.() 0* 112nm625k.m07 X 0.-1320m末给H出394Jm0F32 O22-149 pm 200kJ-mol- 1 15. 丁二烯:,苯:,丙烯基:,N,04:g NO:Π,SO:i,Co22个. Li 6 、2 N NO O NO (1o)(2σ)P(3o)(4o)(1π)(5o) NO: 1o)2(2o)}2(3o)2(4o)21x)(5o2(2π) 往级:NO52、NO3、NO2 稳定性:NO>NO>NO
18 对离中心原子远,所以前者成键电子对 之间的排斥力大,键角大,而后者成键 电子对之间的排 斥力小,键角小。 PH3 的键角小于 PF3 的键角,是由于 P 原子存在 3d 空轨道,F 原子上的孤电子 对可以占有 P 原子的 3d 空轨道,使得中 心原子电子密度增大,成键电子对离中 心原子反而更近,排斥力更大,所以 PF3 的键角大于 PH3。 8. 物种 杂化方式 几何构型 (1) AsF4 − sp 3 d 歪四面体 (2) XeOF3 + sp 3 d 歪四面体 (3) SF5 + sp 3 d 三角双锥 (4) Cl2CO sp2 平面三角型 (5) HO2 − sp 3 V 型 (6) HNO3 sp 2 平面三角型 (7) I3 + sp 3 V 型 (8) I3 − sp 3 d 直线型 9.(1) H2 − 1s 1s σ1s σ1s* Li2 2s 2s σ2s σ2s* Be2 2s 2s σ2s σ2s* B2 2p 2p N2 + 2p 2p O2 2p 2p F2 − 2p 2p (2) N2 + 最稳定,Be2 不存在。 (3) B2、N2 + 、H2 − 、O2、F2 − 有顺磁性。 10. N2 分子。 11. (1) CN+ 的键级为 2;CN− 的键级为 3; (2) CO;(3) B2、NO− 和 C2 + 有顺磁性。 12. 5 个原子全部共平面。 13. (1) CH2 = CH—CH = CH2 所有 C 原子都采取 sp 2 杂化 (2) CH3—CH = C =CH2 sp 3 sp 2 sp sp 2 (3) CH≡C—CH = CH2 sp sp sp 2 sp 2 (4) CH3COCH = CHCH3 sp 3 sp 2 sp 2 sp 2 sp 3 14. (1) KO2、Na2O2、O2 + PtF6 − ; (2) O2 2− 反磁性; (3) 型体 原子间距离 键能 键级 O2 121 pm 490kJ⋅mol−1 2 O2 + 112 pm 625kJ⋅mol−1 5/2 O2 − 132 pm 未给出(394kJ⋅mol−1 ) 3/2 O2 2− 149 pm 200kJ⋅mol−1 1 15. 丁二烯: 4 Π4 ,苯: 6 Π6 ,丙烯基: 3 Π3 ,N2O4: 8 Π6 , NO3 − : 6 Π4 , SO3: 6 Π4, CO2:2 个 4 Π3 。 16. 2p 2p 2s 2s 1s 1s 2π 1π 5σ 4σ 3σ 2σ 6σ 1σ N NO O NO: 2 2 2 2 4 2 1 (1σ ) (2σ ) (3σ ) (4σ ) (1π ) (5σ ) (2π ) NO+ : 2 2 2 24 2 (1 ) (2 ) (3 ) (4 ) (1 ) (5 ) σ σσ σπσ NO− : 2 2 2 24 2 2 (1 ) (2 ) (3 ) (4 ) (1 ) (5 ) (2 ) σ σσ σπσ π 键级: NO 5/2、NO+ 3、NO− 2 稳定性: NO+ > NO > NO−

17. 分子或离子N-O健级N一O健长(pm 子相同,随着阳离子半径增大,熔点降低, .品格能降低:从NaF、NaCI、NaBr、Nal NO 3 106.2 NO 来看,阳离子相同,随着阴离子半径增大 2.5 115.4 熔点降低,晶格能降低:∴U∝1/r。 N-o 15 118.8 NO 4/3 1256 NHOH' 142.0 <a,0的电荷>Cr的电荷: Al[Ne] 8电子构型 ∴U∝离子电荷(±ZC). [Ar]3d 9~17电子构型 41.SiC>Mgo>Mgs NaCI>KCI Pb2 [Xe]4f45d!6s 18+2电子构型 42.(1)Na是8电子构型,Ag是18电子构型 [Ar]3d10 18电子构型 CT离子对Na的附加极化作用小于对 Cr [Ar]3d 9一17电子构型 Ag的附加极化作用,AgCI难溶。 Ca2 [Ar] 8电子构型 (2)从BC2→Ba2离子半径增大,对C0, BrK可 8电子构型 的反极化作用变小,所以C0,2的稳定 TI [Xe)4f45d6s 18+2电子构型 性增加。 19.193pm (3)LiF难溶于水。由于离子半径相近,Li正 20.(1)174pm:(2)54pm. 的品格能较大。 21.3.965×10kgm2s2mol=3.965M0mol 43. (1)Ag'.(2)Be2,(3)Li",(4)TiV,(5)Cu 22.6.63×10kgm2s2mol厂=663 kJmol 23.228pm C-CH K C-C H 24174MJ-mo-1 第一种偶极矩为零 25.E=-332.3mol广':Ea-348.27 J-mo 45.(1)ZnO>ZnS (2)BCly<InCls (3)HI<HCI 26. ,=A:H -A H Du:-In (4)H2S-H2Se ()NH<NF;(6) AsH<NH (7)IBr<ICI (8)H-O>OF -Da-4+Uu<0,U>0) 46 ()分子间氢键:(2)无氢键:(3)分子间氢 27_7872kL.m0 键:(4)分子间氢键:(⑤)无氢链。 28. -5964kmol 47.H0○CH0形成分子间氢键,所以 29.-6kJm0厂1 3 -96.6 kJ-mol-1 熔、沸点高:「 ○形成分子内氢键, 31 =35 kJ-mol- 熔沸点低 32.-749kmol 48.()色散力: 33.(1)1533kJ-mo(2)-243kJmo广 (②)取向力、诱导力、色散力、氢键 (3)-876 kJ-mol (3)取向力、诱导力、色散力: 341 kJ-mol:Nag)的mol百分数=53% (④)诱导力、色散力、氢键 35.273.5kmol (⑤)取向力、诱导力、色散力、水分子之间 36.280 kJ-mol- 氢键。 37.415.8 kJ-mol 49.()离子品体:(2)分子品体:(3)金属品体 38 589.4 kJ-mol- (4)离子晶体:(⑤)原子品体。 39.3288kmol 50.(1)4:(2)407.3pm:(3)19.42gcm 从NaCI、KC、RbCI、CsCI来看,阴离
19 17. 分子或离子 N—O 键级 N—O 键长 (pm) NO+ 3 106.2 NO 2.5 115.4 N2O 1.5 118.8 NO3 − 4/3 125.6 NH3OH+ 1 142.0 18. Al3+ [Ne] 8 电子构型 Fe3+ [Ar]3d5 9~17 电子构型 Pb2+ [Xe]4f145d106s2 18+2 电子构型 Zn2+ [Ar]3d10 18 电子构型 Cr3+ [Ar]3d3 9~17 电子构型 Ca2+ [Ar] 8 电子构型 Br− [Kr] 8 电子构型 Tl+ [Xe]4f145d106s2 18+2 电子构型 19. 193 pm 20. (1) 174 pm;(2) 54 pm。 21. 3.965×106 kg·m2 ·s−2 ·mol−1 =3.965 MJ·mol−1 22. 6.63×105 kg·m2 ·s−2 ·mol−1 =663 kJ·mol−1 23. 228 pm 24. 1.74 MJ·mol−1 25. E(F)= -332.3 kJ·mol−1 ;E(Cl)= -348.27 kJ·mol−1 26. NH f m,NH Cl f m,NH H H 3 4 32 1 2 p =Δ −Δ − − H H DI Cl Cl 2 1 2 − −+ D AU (A < 0,U > 0) 27. −787.2 kJ⋅mol−1 28. −5964 kJ⋅mol−1 29. −6 kJ⋅mol−1 30. −96.6 kJ⋅mol−1 31. −35 kJ⋅mol−1 32. −749 kJ⋅mol−1 33. (1)1533 kJ⋅mol−1 ;(2) −243 kJ⋅mol−1 ; (3) −876 kJ⋅mol−1 34. 1 kJ⋅mol−1 ;Na(g)的 mol 百分数=53%。 35. 273.5 kJ⋅mol−1 36. 280 kJ⋅mol−1 37. 415.8 kJ⋅mol−1 38. 589.4 kJ⋅mol−1 39. 328.8 kJ⋅mol−1 40. 从 NaCl、KCl、RbCl、CsCl 来看,阴离 子相同,随着阳离子半径增大,熔点降低, ∴晶格能降低;从 NaF、NaCl、NaBr、NaI 来看,阳离子相同,随着阴离子半径增大, 熔点降低,∴晶格能降低;∴U ∝ 1/r 。 从CaO熔点远远高于KCl的熔点来看, 2+ + Ca K r r < ,Ca2+的电荷>K+ 的电荷;同样, O2 Cl r r − < − ,O2− 的电荷>Cl− 的电荷; ∴U ∝ 离子电荷(±Ze)。 41. SiC > MgO > MgS > NaCl > KCl 42. (1) Na+ 是 8 电子构型,Ag+ 是 18 电子构型, Cl− 离子对 Na+ 的附加极化作用小于对 Ag+ 的附加极化作用,∴AgCl 难溶。 (2) 从 Be2+→ Ba2+离子半径增大,对 CO3 2− 的反极化作用变小,所以 CO3 2− 的稳定 性增加。 (3) LiF 难溶于水。由于离子半径相近,LiF 的晶格能较大。 43. (1) Ag+ ,(2) Be2+ ,(3) Li+ ,(4) TiIV,(5) Cu2+ 44. C=C H F H F C=C H F H F C=C H F H F , 第一种偶极矩为零。 45. (1) ZnO>ZnS (2) BCl3<InCl3 (3) HI<HCl (4) H2S>H2Se (5) NH3<NF3 (6) AsH3<NH3 (7) IBr<ICl (8) H2O>OF2 46. (1) 分子间氢键;(2) 无氢键;(3) 分子间氢 键;(4) 分子间氢键;(5) 无氢键。 47. HO CHO 形成分子间氢键,所以 熔、沸点高; CHO OH 形成分子内氢键, 熔沸点低。 48. (1) 色散力; (2) 取向力、诱导力、色散力、氢键; (3) 取向力、诱导力、色散力; (4) 诱导力、色散力、氢键; (5) 取向力、诱导力、色散力、水分子之间 氢键。 49. (1) 离子晶体;(2) 分子晶体;(3) 金属晶体; (4) 离子晶体;(5) 原子晶体。 50. (1) 4;(2) 407.3 pm;(3) 19.42 g·cm−3

51.4.25×102g:25.54% 59.(I)NF(IoY2oY(3oY(4aY(5aY(I)(2xj 52.(1)1.3A:(2)3A:(3)两个 NF'(1a)2a)(3a)(4a)(5aY(1a)(2x)' 53.() NF-(1a)2a)(3aY(4a)(5a)(1a)(2x) (2)NF键级2:NF键级25:NF键级15: (3)均有顺磁性,不成对电子数分别为N 有2个:NF有1个:NF有1个。 0 60. (2)a=415.75pm NO有两种可能的共振结构,更稳 (3)x=0.92:NigNi"60 定,N一O罐离解所需能量高。 (4)293.9pm. (2)N0(1)2o3oP41x)5c)2x) 54.(1)a=5.43A:(2)2.35A:(3)34% CF(1c)2c)23o)4o5o1π)'2x) 55. ) N、O原子序数相近,相应原子轨道的 能级相近,成健后能量降低更多,更稳定: 而C、F原子序数相差大,原子轨道能级相 差大,成键时重叠程度差,另外C℉分子轨 道中有一部分F单方面提供的非键电子, 故稳定性低于NO。 (2)2:3 61.(仙)如果把0,2看作0和0的结合,由于 ()石墨每层中的离域x键为Π:,苯中的 它们带同性电荷要互相排斥,可以预期 离域π键为,乙烯中是定域π键, 0,不可能存在,但0与N是等电 所以π键的重叠程度为石墨<苯<乙烯, 体: 非斥力 所以碳碳键的键长石墨>苯>乙烯, 最,东 能音味若O从无穷相石靠折 56.()C0,C0晶体是分子晶体 要跃过“火山”峰才能到达能最最低点 (2)C可在星际空间存在,星际空间基本上 71 9 kcal 都是呈真空状态,有利于分子晶体存在 (③)在热力学上不稳定,在动力学上稳定。 (4)0,2的离解能应在图中能量最低的位 金刚石在死火山口存在,由于经历 置,为85.6 kcal-mol 过高温高压,有利于金刚石的生成 (⑤)O,2可储存的能量=86.3 kcal-mol'。 57. C8: 1个02 离子可储存的能 Π 33 kcal分子 碳氧键长:C0<CO2<HCHO<HCOOH 58.(1)(1o)2oj3a1x (2)1x: (3)定域在氧原子上: (4)OH的最低能最电子跃迁是30→1:OH 的最低能量电子跃迁是1x→4o,4o是 反键分子轨道,能量升高,故OH的最 低能量电子跃迁需要的能量低
20 51. 4.25×10−22 g;25.54% 52. (1) 1.3 Å;(2) 3 Å;(3) 两个。 53. (1) (2) a = 415.75 pm; (3) x=0.92; II III Ni Ni O 0.76 0.16 ; (4) 293.9 pm。 54. (1) a = 5.43 Å;(2) 2.35 Å;(3) 34%。 55. (1) (2) 2:3; (3) 石墨每层中的离域 π 键为 n Πn ,苯中的 离域 π 键为 6 Π6 ,乙烯中是定域 π 键, 所以 π 键的重叠程度为石墨<苯<乙烯, 所以碳碳键的键长石墨>苯>乙烯。 56. (1) C60,C60晶体是分子晶体; (2) C60 可在星际空间存在,星际空间基本上 都是呈真空状态,有利于分子晶体存在; 金刚石在死火山口存在,由于经历 过高温高压,有利于金刚石的生成。 57. C πO σ π 配键 O σ C σ O 4 3 4 3 Π Π H C H O σ π σ σ σ σ C H O H σ O σ 4 Π3 碳氧键长:CO < CO2 < HCHO < HCOOH 58. (1) (1σ) 2 (2σ) 2 (3σ) 2 (1π) 3 (2) 1π; (3) 定域在氧原子上; (4) OH 的最低能量电子跃迁是 3σ→1π;OH- 的最低能量电子跃迁是 1π→4σ,4σ 是 反键分子轨道,能量升高,故 OH 的最 低能量电子跃迁需要的能量低。 59. (1) NF (1σ) 2(2σ) 2 (3σ) 2 (4σ) 2 (5σ) 2 (1π) 4 (2π) 2 NF+ (1σ) 2(2σ) 2 (3σ) 2 (4σ) 2 (5σ) 2 (1π) 4 (2π) 1 NF− (1σ) 2(2σ) 2 (3σ) 2 (4σ) 2 (5σ) 2 (1π) 4 (2π) 3 (2) NF 键级 2;NF+ 键级 2.5;NF− 键级 1.5; (3) 均有顺磁性,不成对电子数分别为 NF 有 2 个;NF+ 有 1 个;NF− 有 1 个。 60. (1) N=O N=O C=F NO 有两种可能的共振结构,更稳 定,N―O 键离解所需能量高。 (2) NO (1σ) 2(2σ) 2 (3σ) 2 (4σ) 2 (1π) 4 (5σ) 2 (2π) 1 CF (1σ) 2(2σ) 2 (3σ) 2 (4σ) 2 (5σ) 2 (1π) 4 (2π) 1 N、O 原子序数相近,相应原子轨道的 能级相近,成键后能量降低更多,更稳定; 而 C、F 原子序数相差大,原子轨道能级相 差大,成键时重叠程度差,另外 CF 分子轨 道中有一部分 F 单方面提供的非键电子, 故稳定性低于 NO。 61. (1) 如果把 O2 2+看作 O+ 和 O+ 的结合,由于 它们带同性电荷要互相排斥,可以预期 O2 2+不可能存在,但 O2 2+与 N2 是等电子 体,意味着 O2 2+中存在共价叁键,释放 的巨大键能克服了静电排斥力,而使 O2 2+存在。 (2) 最小动能意味着 O+ 从无穷远相互靠近, 要跃过“火山”峰才能到达能量最低点, 从图上看 Ek(min)=171.9 kcal·mol-1。 (3) 在热力学上不稳定,在动力学上稳定。 (4) O2 2+的离解能应在图中能量最低的位 置,为 85.6 kcal·mol-1。 (5) O2 2+可储存的能量=86.3 kcal·mol-1。 1 个 O2 2+ 离子可储存的能量 =1.433×10-22 kcal·分子–1。 (6) O+ —O+ 的键长≈1.1 Å。 (7)~1.6 Å