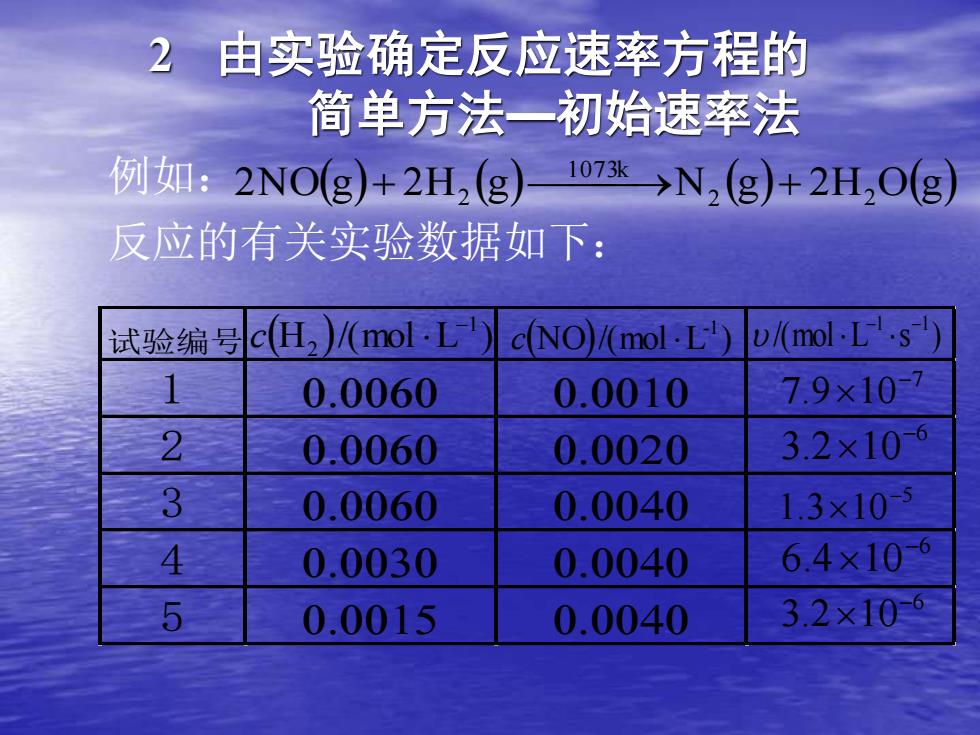
由实验确定反应速率方程的 简单方法一初始速率法 例如:2NO(g+2H,(g)17k→N,(g)+2H,O(g 反应的有关实验数据如下: 试验编号c(H2)/(mol.L) c(NO)/(mol.L) /(mol.L.s 0.0060 0.0010 7.9×10 2 0.0060 0.0020 3.2×106 3 0.0060 0.0040 1.3x10国 4 0.0030 0.0040 6.4x10 5 0.0015 0.0040 3.2x10
例如: 反应的有关实验数据如下: 2N O(g) 2H (g) N (g) 2H O(g) 2 2 1073k + 2 ⎯ ⎯→ + 试验编号 1 6 2 6 3 6 4 4 3 4 5 5 4 (H )/(mol L ) 1 2 − c (NO)/(mol L ) -1 c /(mol L s ) −1 −1 7 7.9 10− 6 3.2 10− 5 1.3 10− 6 6.4 10− 6 3.2 10− 2 由实验确定反应速率方程的 简单方法—初始速率法

该反应的速率方程式: =k[c(NO)Pc(H2 对NO而言是二级反应,对H,而言是 级反应。 试问如何求出反应速率系数?
该反应的速率方程式: (NO) (H ) 2 2 = k c c 对NO而言是二级反应,对H2而言是一 级反应。 试问如何求出反应速率系数?

3浓度与时间的定量关系 N,O,在CCI,中的分解速率方程为: v=kcN,O,)亦可写为: =kd(N.O.). dc dc kdr dt C de(NO)=[kdr In(N.O) =-k1 c(N,O.) c,(N,O.) 通式:n 9(A) =-k(一级反应) Co(A) 又:n{c,(A)}=-kt+lnc(A)
N2 O5 在CCl4 中的分解速率方程为: ( ) N2 O5 = kc 亦可写为: k t c c d d − = kt c ct = − (N O ) (N O ) ln 0 2 5 2 5 − = t t c c k t c 0 0 2 5 2 5 d c(N O ) d (N O ) 通式: (一级反应) (A) (A) ln 0 k t c ct = − 3 浓度与时间的定量关系 (N O ) , d d 2 5 k c t c − = 又:lnct (A)= −k t + lnc0 (A)