
臭氧 斯特里利用一个直径为一英 gO),发现它很快就放气体。 他國聳的性质进行研究发现,蜡烛在这种 史燃烧的火悠非常大,他又将老鼠放在这种气体中, 等体税凝常空气中活的时间约长了四倍。 趣自已也亲自尝试了一下,“觉得这种空气使呼 吸供文诈多猿凡感到格外舒畅”。 但他积类空是单一的气体,助燃能力不同是由 于然素含量的同从汞煅灰分解出来的是新鲜的,一 点燃素都没的空气,所以吸收燃素能力特别强,助燃 能力格外大,所以他把这种气体叫做“脱燃素空气” 一旦空气被燃素所触和,那么它就不再会助燃,而变成 “被燃素饱和了的空气”(也就是我们今天说的氮气)。 普利斯特里(1733一1804),英国化学家
氧和臭氧 2、1774年8月1日普利斯特里利用一个直径为一英 尺的聚光镜来加热汞煅灰(HgO),发现它很快就放气体。 他对这种气体的性质进行研究发现,蜡烛在这种 气体中燃烧的火焰非常大,他又将老鼠放在这种气体中, 比在等体积的寻常空气中活的时间约长了四倍。 他自己也曾亲自尝试了一下,“觉得这种空气使呼 吸轻快了许多,使人感到格外舒畅”。 但他仍认为空气是单一的气体,助燃能力不同是由 于燃素含量的不同;从汞煅灰分解出来的是新鲜的,一 点燃素都没有的空气,所以吸收燃素能力特别强,助燃 能力格外大,所以他把这种气体叫做“脱燃素空气”; 一旦空气被燃素所饱和,那么它就不再会助燃,而变成 “被燃素饱和了的空气”(也就是我们今天说的氮气)

舍勒 并制得了氧 气,由于他 格斯指出 的:“从歪 循着错误 的、弯曲 真理碰到鼻 辩证法》。 并使化学发 实”.(马 克思《资 不久 普利斯特里 有关氧的 材料联系起 来,并摆 之后,终 的分析判断 :了燃烧和 空气的真 并建立起科 学燃烧学 拉瓦锡(1743-1794)法国化学家
氧和臭氧 舍勒和普利斯特里虽然都独立地发现并制得了氧 气,由于他们被传统的燃素说所束缚,正如恩格斯指出 的:“从歪曲的、片面的、错误的前提出发,循着错误 的、弯曲的,不可靠的途径行进。往往当真理碰到鼻 尖上的时候还是没有得到真理”(《自然辩证法》。 结果“这种本来可以推翻全部燃素说观点并使化学发 生革命的元素,在他们手中没有能结出果实”.(马 克思《资本论》) 不久后,法国化学家拉瓦锡了解到了普利斯特里 有关氧的试验,他在把大量的精确的实验材料联系起 来,并摆脱了传统思想的束缚,作了科学的分析判断 之后,终于找到了燃素说错误的根源,揭示了燃烧和 空气的真实连系.完成了彻底推翻燃素说并建立起科 学燃烧学说这一历史任务。 拉瓦锡(1743-1794)法国化学家

氧和臭氧 二、氧形成化合物的价键特征 氧几乎能同所有的其它元素直接或间接地化合生成 类型不同数量众多的化合物。这不仅是由于在氧原子中 有成单电子而且在氧分子中也有成单电子,在03分子中 又有离域Ⅱ键。现将氧的成键特征分述如下: 1、氧原子形成化合物时的成健特征: ①氧原子的电负性仅次于氟,它从电负性较小的元素 化合而夺取电子形成O2离子如:LO,即离子型氧化物 (2)氧原子与电负性较大元素(高氧化态金属元素和 非金属元素)化合,共用电子对形成两个共价单健,一。一 如:H20、C1,0即共价型氧化物。 (③)氧原子的半径小电负性大,有形成多重键的倾向。 如: 尿素 、>C=0中碳碳双键, O三C中的叁键
氧和臭氧 二、氧形成化合物的价键特征 氧几乎能同所有的其它元素直接或间接地化合生成 类型不同数量众多的化合物。这不仅是由于在氧原子中 有成单电子而且在氧分子中也有成单电子,在O3分子中 又有离域Π键。现将氧的成键特征分述如下: 1、氧原子形成化合物时的成健特征: (l)氧原子的电负性仅次于氟,它从电负性较小的元素 化合而夺取电子形成O2-离子如:LiO2即离子型氧化物 (2)氧原子与电负性较大元素(高氧化态金属元素和 非金属元素)化合,共用电子对形成两个共价单健, 如:H2O、Cl2O即共价型氧化物。 O C H2N H2N O2 O C (3)氧原子的半径小电负性大,有形成多重键的倾向。 如:尿素 中碳碳双键, 中的叁键
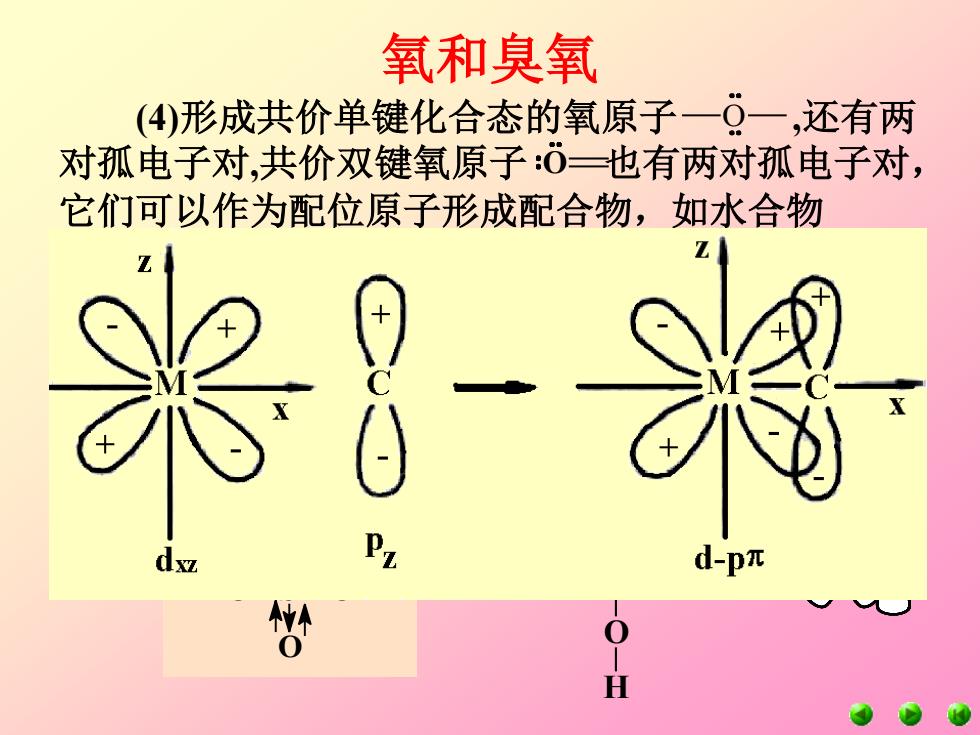
氧和臭氧 (4)形成共价单键化合态的氧原子一Q一,还有两 对孤电子对,共价双键氧原子:δ三也有两对孤电子对, 它们可以作为配位原子形成配合物,如水合物 1 l-pπ 0 H
(5)氧原子可以把两个单电子以相反自旋归并, 空出一个2p轨道接受外来配位电子而成键,例如;含 氧酸根中的p-p配键及d-p配键。如: (4)形成共价单键化合态的氧原子 ,还有两 对孤电子对,共价双键氧原子 也有两对孤电子对, 它们可以作为配位原子形成配合物,如水合物 {[Fe(H2O)6 ] 2+}、醚合物、醇合物等。 O O 氧和臭氧 H O S O H O O H O P O H O O H 反馈键 H O S O H O O
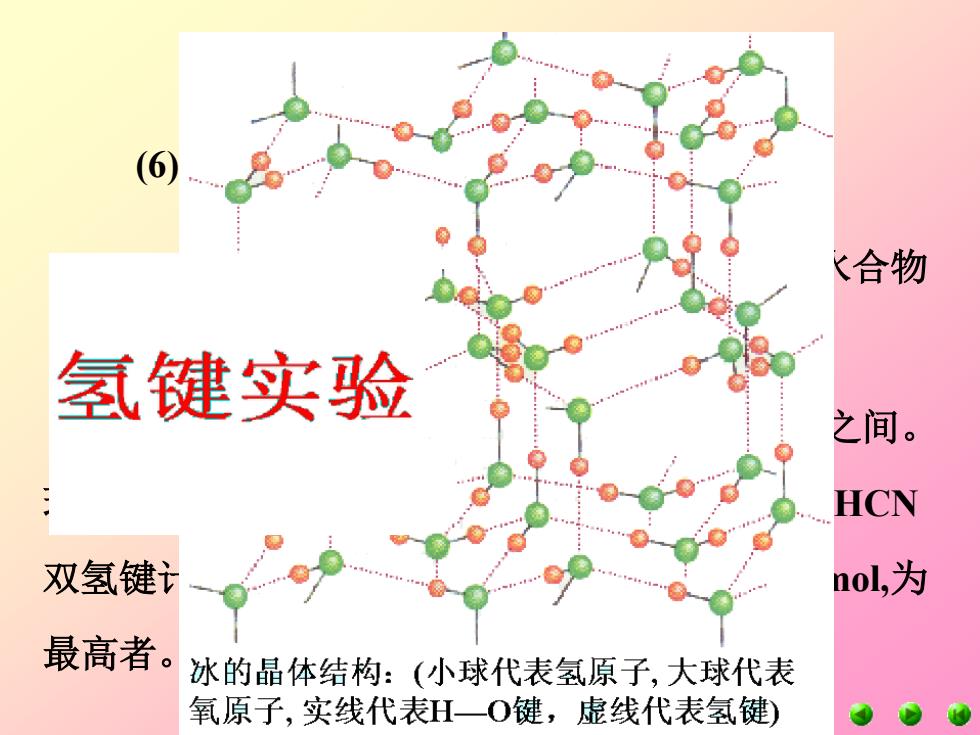
K合物 氢键实验 之间。 HCN 双氢键 nol,为 最高者。 冰的晶体结构:(小球代表氢原子,大球代表 氧原子,实线代表H一O键,虚线代表氢键)
(7)它们可以作为配位原子形成配合物,如水合物 {[Fe(H2O)6 ] 2+}、醚合物、醇合物等。 (8)新氢键:标准的氢键键能在20-40kJ/mol之间。 现在发现有一种新的双氢键B-H…H-A。BH4 –…HCN 双氢键计算键长1.709埃,为最小者,键能75.44kJ/mol,为 最高者。 氧和臭氧 (6)氧原子可以形成氢键