
16-2-2 氮的氢化物 五、叠氮酸HN3) 无色有刺激性的液体,沸点308.8K,熔点193K。 它是易爆物质,只要受到撞击就立即爆炸而分解: 2HN3===3N2+H2 A,He=-593.6kJ/mol 因为HN3的挥发性高,可用稀HSO4与NaN3作用 制备HN3: NaN3+H2SO===NaHSO+HN3 HN3的水溶液为一元弱酸(K=1.9×10-5) 活泼金属如碱金属和钡等的叠化物,加热时不 爆炸,分解为氮和金属。 2NaN3(s)==2Na(①)+3N2(g) 加热LiN3则转变为氨化物。象Ag、 Cu、Pb、 Hg等的叠氮化物加热就发生爆炸
16-2-2 氮的氢化物 五、叠氮酸(HN3 ) 无色有刺激性的液体,沸点308.8K,熔点193K。 它是易爆物质,只要受到撞击就立即爆炸而分解: 2HN3===3N2+H2 rH=-593.6kJ/mol 因为HN3的挥发性高,可用稀H2SO4与NaN3作用 制备HN3: NaN3+H2SO4===NaHSO4+HN3 HN3的水溶液为一元弱酸(Ka=1.9×10-5 ) 活泼金属如碱金属和钡等的叠化物,加热时不 爆炸,分解为氮和金属。 2NaN3 (s)===2Na(l)+3N2 (g) 加热LiN3则转变为氮化物。象Ag、Cu、Pb、 Hg等的叠氮化物加热就发生爆炸

16-2-2 氮的氢化物 HN3的分子结构如图:
16-2-2 氮的氢化物 HN3的分子结构如图:

16-2-3 氮的含氧化合物 氮的氧化物 1.一氧化氮 3Cu+8HNO===3Cu(NO)+2NO1+4H2O NO微溶于水,但不与水反应,不助燃,在常温下极易与氧 反应,还能与F2、C2、Br2、等反应生成卤化亚硝酰。 2NO+CI,-2NOCI NO共有11个价电子,其结构为NOKK(σ2s)(o2s (2p(匹2p(c2rP(匹p)l,由一个o键,一个双电字元键和一 个3电子元键组成。在化学上这种具有奇数价电子的分子称 奇分子。通常奇分子都有颜色,而NO或N2O2NO的双聚体) 都是无色的,只是当混有NO3时才显蓝色。NO很容易与吸 附在容器壁上的氧反应生成NO2,NO2与NO结合生成N2O
16-2-3 氮的含氧化合物 一、氮的氧化物 1.一氧化氮 3Cu+8HNO3===3Cu(NO3 )2+2NO↑+4H2O NO微溶于水,但不与水反应,不助燃,在常温下极易与氧 反应,还能与F2、Cl2、Br2、等反应生成卤化亚硝酰。 2NO+Cl2===2NOCl NO共有11个价电子,其结构为NO[KK(2s) 2 (2s * ) 2 (2p) 2 (y2p) 2 (z2p) 2 (z2p * ) 1 ],由一个键,一个双电子键和一 个3电子键组成。在化学上这种具有奇数价电子的分子称 奇分子。通常奇分子都有颜色,而NO或N2O2 (NO的双聚体) 都是无色的,只是当混有N2O3时才显蓝色。NO很容易与吸 附在容器壁上的氧反应生成NO2 ,NO2与NO结合生成N2O3
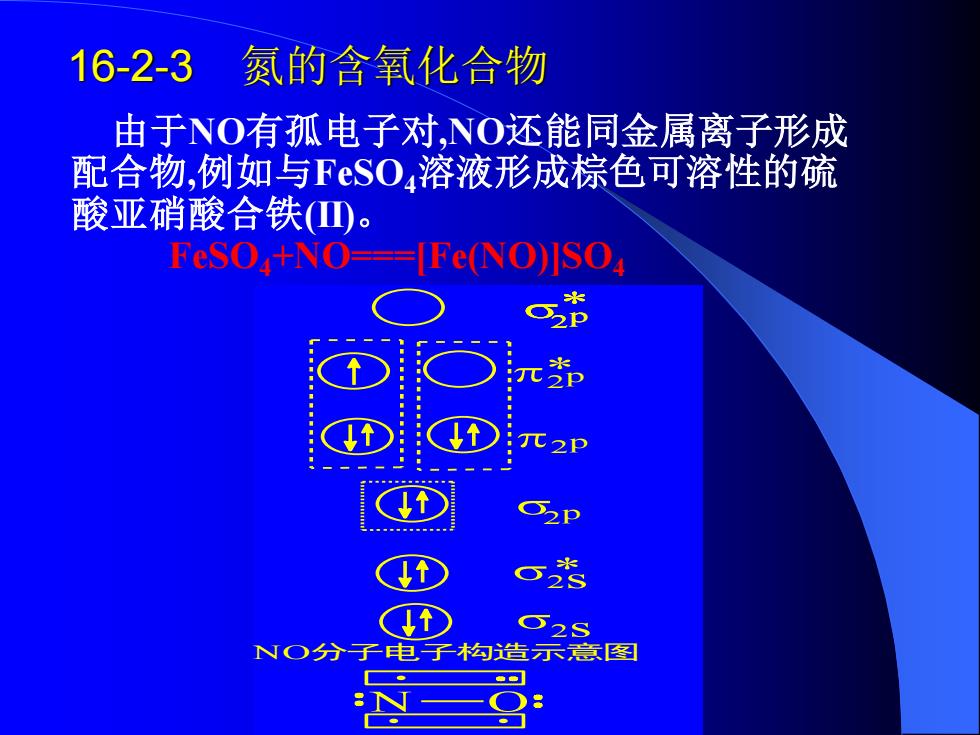
16-2-3 氮的含氧化合物 由于NO有孤电子对,NO还能同金属离子形成 配合物,例如与FeSO4溶液形成棕色可溶性的硫 酸亚硝酸合铁(山。 FeSo+NO===FeNO)ISO 2P 62P 。 52S NO分子电子构造示意图
16-2-3 氮的含氧化合物 由于NO有孤电子对,NO还能同金属离子形成 配合物,例如与FeSO4溶液形成棕色可溶性的硫 酸亚硝酸合铁(II)。 FeSO4+NO===[Fe(NO)]SO4 NO分子电子构造示意图 2 p *2 p *2 p 2 p 2 *s 2s N O
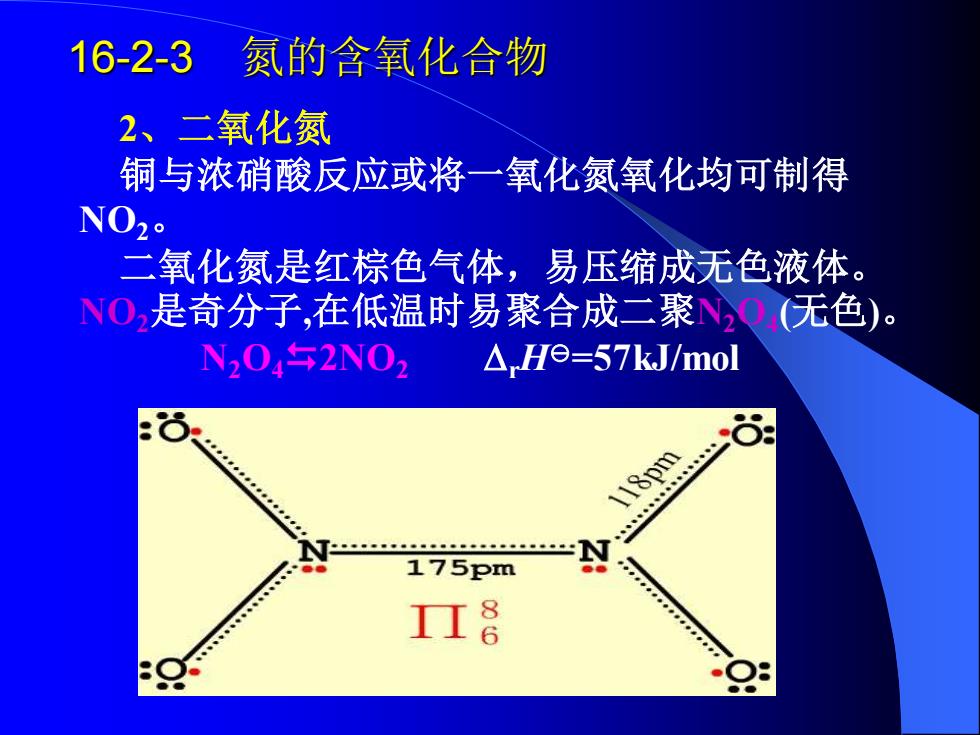
16-2-3 氮的含氧化合物 2、二氧化氮 铜与浓硝酸反应或将一氧化氮氧化均可制得 NO20 二氧化氮是红棕色气体,易压缩成无色液体。 NO,是奇分子,在低温时易聚合成二聚NO无色)。 N204午2N02 △He=57kJ/mol 6 )18pm 175pm 8
16-2-3 氮的含氧化合物 2、二氧化氮 铜与浓硝酸反应或将一氧化氮氧化均可制得 NO2。 二氧化氮是红棕色气体,易压缩成无色液体。 NO2是奇分子,在低温时易聚合成二聚N2O4 (无色)。 N2O42NO2 rH=57kJ/mol