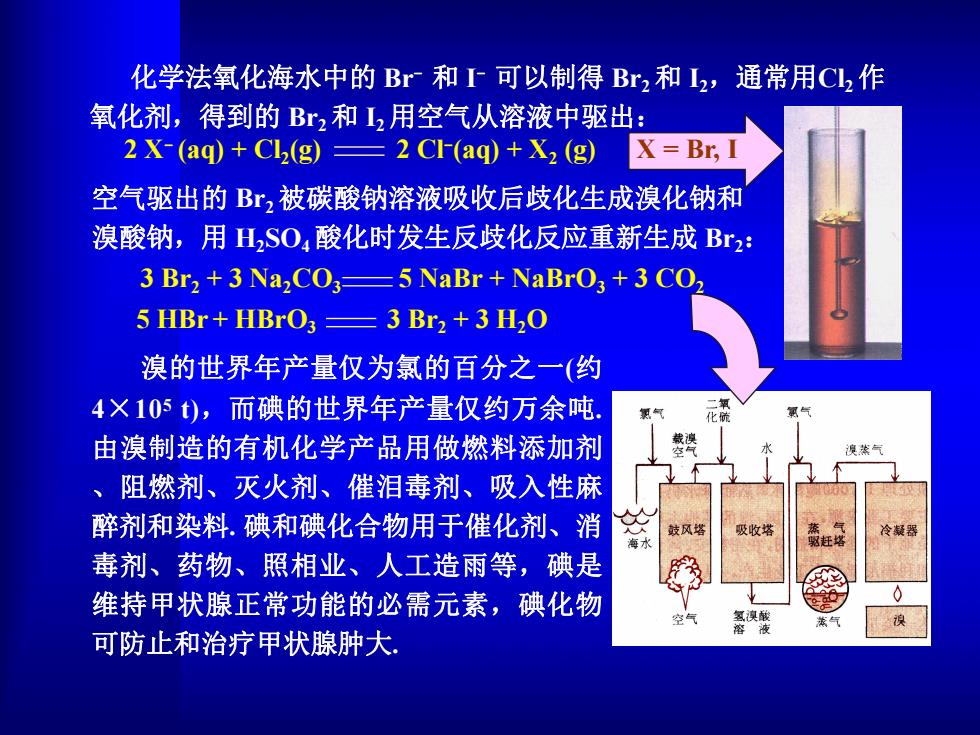
化学法氧化海水中的Br和T可以制得Br2和I2,通常用CL2作 氧化剂,得到的Br2和I2用空气从溶液中驱出: 2X-(aq)+Cl(g)=2 CI-(aq)+X2 (g) X=Br,】 空气驱出的Br,被碳酸钠溶液吸收后歧化生成溴化钠和 溴酸钠,用H2SO4酸化时发生反歧化反应重新生成Br2: 3 Br2+3 Na,CO3=5 NaBr NaBrO3+3 CO 5 HBr+HBrO33 Br2 +3 H2O 溴的世界年产量仅为氯的百分之一(约 4×105t),而碘的世界年产量仅约万余吨. 由溴制造的有机化学产品用做燃料添加剂 、阻燃剂、灭火剂、催泪毒剂、吸入性麻 醉剂和染料.碘和碘化合物用于催化剂、消 及收塔 毒剂、药物、照相业、人工造雨等,碘是 维持甲状腺正常功能的必需元素,碘化物 氢溴酸 可防止和治疗甲状腺肿大
化学法氧化海水中的 Br - 和 I - 可以制得 Br2和 I2,通常用Cl2作 氧化剂,得到的 Br2和 I2用空气从溶液中驱出: 2 X- (aq) + Cl2(g) 2 Cl-(aq) + X2 (g) X = Br, I 空气驱出的 Br2被碳酸钠溶液吸收后歧化生成溴化钠和 溴酸钠,用 H2SO4酸化时发生反歧化反应重新生成 Br2: 溴的世界年产量仅为氯的百分之一(约 4×105 t),而碘的世界年产量仅约万余吨. 由溴制造的有机化学产品用做燃料添加剂 、阻燃剂、灭火剂、催泪毒剂、吸入性麻 醉剂和染料. 碘和碘化合物用于催化剂、消 毒剂、药物、照相业、人工造雨等,碘是 维持甲状腺正常功能的必需元素,碘化物 可防止和治疗甲状腺肿大. 3 Br2 + 3 Na2CO3 5 NaBr + NaBrO3 + 3 CO2 5 HBr + HBrO3 3 Br2 + 3 H2O

2 试写出将盐卤中的Br转化为Br2的反应 方程式和电位,从热力学观点B可被O,氧化 为Br2,但为什么不用O2达到此目的? Br用Cl,氧化: Cl2(g)+2 Br (ag)=2 CH(aq)+Br2 (g) E9=1.35V-1.07V=+0.26V 得到的挥发性Br,以蒸气-空气混合物形式离开体系 从热力学角度Br-在酸性溶液中可被O2所氧化: 02(g)+4Br(aq)+4H*(aq=2H200+2Br2(①) E9=1.23V-1.07V=+0.16V 但该反应在pH=7的溶液中不能进行(E=-0.15V).尽管 酸性溶液中反应在热力学上是有利的,但反应速率是否足够大仍 值得怀疑,因为O2的反应涉及约0.6V的超电位.即使酸性溶液 中的反应在动力学上也是有利的,但由于需要将如此大量的盐卤 酸化然后又将废液中和,在经济上显然没有吸引力
Question 2 试写出将盐卤中的 Br -转化为 Br2的反应 方程式和电位,从热力学观点 Br -可被 O2氧化 为 Br2 ,但为什么不用 O2达到此目的? Br -用Cl2氧化: Cl2(g) + 2 Br - (aq) 2 Cl -(aq) + Br2 (g) Eq = 1.35V – 1.07 V = +0.26V 得到的挥发性 Br2以蒸气-空气混合物形式离开体系. 从热力学角度 Br- 在酸性溶液中可被O2所氧化: O2(g) + 4 Br -(aq) + 4 H+(aq) 2 H2O(l) + 2 Br2 (l) Eq = 1.23V – 1.07 V = +0.16V 但该反应在 pH = 7 的溶液中不能进行(E = -0.15V). 尽管 酸性溶液中反应在热力学上是有利的,但反应速率是否足够大仍 值得怀疑,因为 O2的反应涉及约 0.6V 的超电位. 即使酸性溶液 中的反应在动力学上也是有利的,但由于需要将如此大量的盐卤 酸化然后又将废液中和,在经济上显然没有吸引力
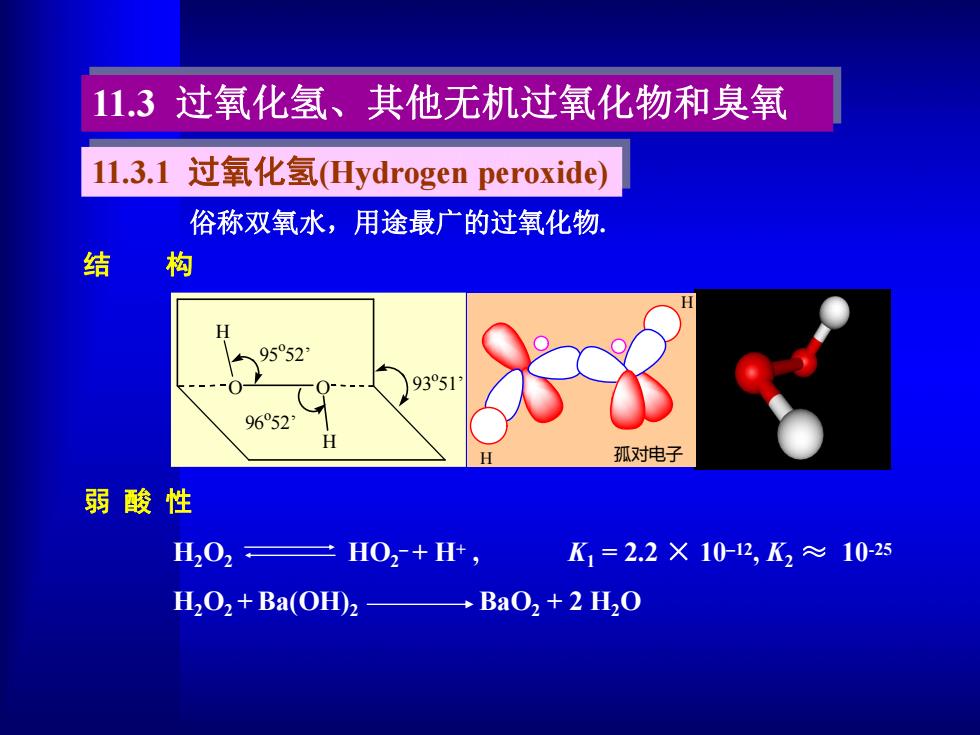
11.3过氧化氢、其他无机过氧化物和臭氧 11.3.1过氧化氢(Hydrogen peroxide) 俗称双氧水,用途最广的过氧化物 构 H 9552 9351 96052 孤对电子 弱酸性 H202三H02+H, K1=2.2×10-12,K2≈102s H2O2+Ba(OH)2 →BaO2+2H2O
O O H H 95 o52’ 96 o52’ 93 o51’ 11.3 过氧化氢、其他无机过氧化物和臭氧 11.3.1 过氧化氢(Hydrogen peroxide) 俗称双氧水,用途最广的过氧化物. 结 构 弱 酸 性 H2O2 HO2 – + H+ , K1 = 2.2 × 10–12 , K2 ≈ 10-25 H2O2 +Ba(OH)2 BaO2 + 2 H2O H H 孤对电子

(生产和应用 世界年产量估计超过1×10t(以纯H,02计).纯过氧化氢为淡蓝色接近无色 的粘稠液体,通常以质量分数为0.35,0.50和0.70的水溶液作为商品投入市场 如欧洲国家将总产量的40%用于制造过硼酸盐和过碳酸盐,总产量的50%用 于纸张和纺织品漂白,在美国则将总产量的25%用于净化水(杀菌和除氯)· ●实验室法BaO,+2HCI BaCl,H,O, BaO2+H2SO,(稀) BaSO4+H2O2(6~8%的水溶液 冷却 NaO,+2H,O= 2 NaOH+H2O2 ● 电解水解法 2HS04→S208+2H++2e(3 (电解NH HSO,) S20?+2H+2H,0+2e→2HS04+H2+H,02(4 减压蒸馏可得含3035%H202的水溶液. 自动氧化法(世界年产量 HO 95%以上由该法生产) +02 +H20 +H2(钯催化剂) OH 由于构成催化循环,反应的实际结果是由H2和02生成H202, ●1990年报道:在催化剂(10%Pt~90%Pd)的作用下,H2和O2的直接燃烧 也可获浓度为18%的H202
(1) 生产和应用 减压蒸馏可得含 30~35% H2O2的水溶液. 世界年产量估计超过1×10 6t(以纯 H2O2 计). 纯过氧化氢为淡蓝色接近无色 的粘稠液体,通常以质量分数为 0.35,0.50 和 0.70 的水溶液作为商品投入市场. 如欧洲国家将总产量的 40 % 用于制造过硼酸盐和过碳酸盐,总产量的 50 % 用 于纸张和纺织品漂白,在美国则将总产量的 25 % 用于净化水(杀菌和除氯). ● 实验室法 BaO2 + 2 HCl BaCl2 + H2O2 BaO2 + H2SO4(稀) BaSO4 + H2O2 ( 6 ~ 8 % 的水溶液) NaO2 + 2 H2O 2 NaOH + H2O2 由于构成催化循环,反应的实际结果是由 H2和 O2生成 H2O2 . ● 1990年报道:在催化剂 (10 % Pt ~ 90 % Pd ) 的作用下,H2和 O2的直接燃 烧 也可获浓度为 18 % 的 H2O2 . ● 电解-水解法 (电解NH4HSO4) ● 自动氧化法(世界年产量 95%以上由该法生产) S O 2H 2H O 2e 2HSO H H O ( ) 2HSO S O 2H 2e ( ) 2 4 2 2 2 2 2 8 2 4 2 8 阴 阳 冷却 OH HO R +H2(钯催化剂) +O2 O O R H2O2
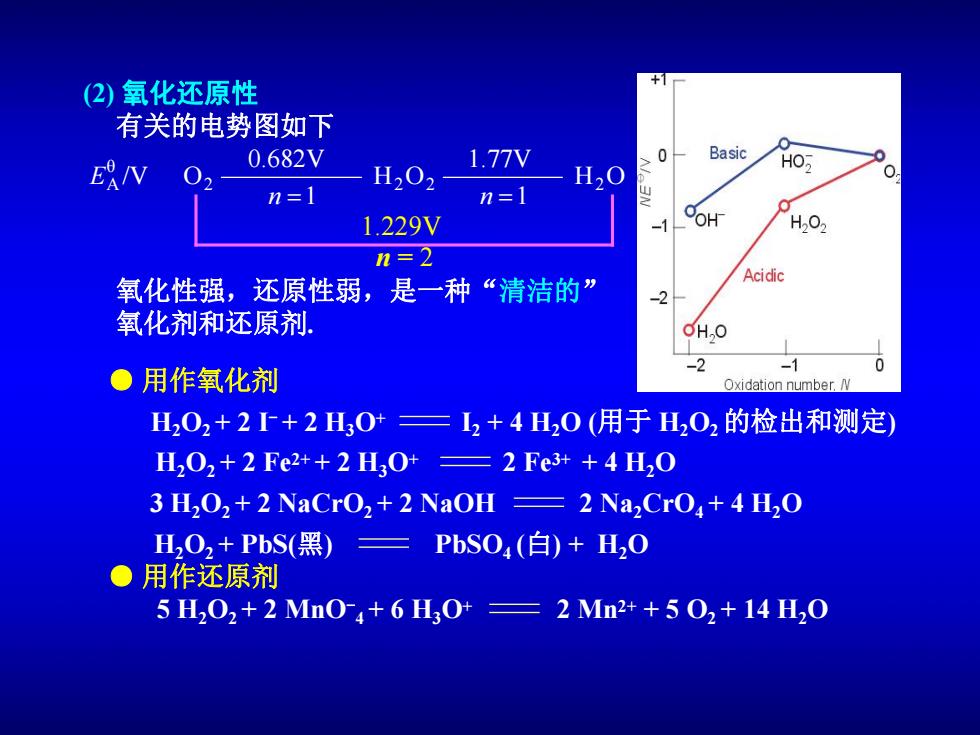
(2)氧化还原性 有关的电势图如下 0 Basic E/V 0.682V 1.77V 02 H02 H,O n=1 1.229V OH H2O n=2 氧化性强,还原性弱,是一种“清洁的” Acidic 氧化剂和还原剂. OHO -2 ●用作氧化剂 Oxidation number.N H202+2r+2H30=12+4H20(用于H202的检出和测定) H202+2Fe2++2H30+=2Fe3++4H20 3 H,O,+2NaCro,+2 NaOH 2 Na,CrO+4 H2O H2O2+PbS(黑) =PbSO4(白)+H,0 ●用作还原剂 5H202+2Mn04+6H0+=2Mn2++502+14H20
(2) 氧化还原性 有关的电势图如下 氧化性强,还原性弱,是一种“清洁的” 氧化剂和还原剂. 5 H2O2 + 2 MnO- 4 + 6 H3O+ 2 Mn2+ + 5 O2 + 14 H2O ● 用作氧化剂 ● 用作还原剂 H2O2 + 2 I - + 2 H3O+ I2 + 4 H2O (用于 H2O2的检出和测定) H2O2 + 2 Fe 2+ + 2 H3O+ 2 Fe 3+ + 4 H2O 3 H2O2 + 2 NaCrO2 + 2 NaOH 2 Na2CrO4 + 4 H2O H2O2 + PbS(黑) PbSO4 (白) + H2O H O 1 1.77V H O 1 0.682V /V O2 2 2 2 θ A n n E 1.229V n = 2