
例3:用离子电子法配平下列各反应方程式 (1)PH4+Cr20,2-→P4+Cr3+ (2)CuO+NH3→Cu+N2 (3)Zn+SCN->Zn2+H2S HCN (4)Fe +NO2>Fe22+NH3 (5)N2H4 Cu(OH)2>N2 Cu 16
例3:用离子电子法配平下列各反应方程式 (1) PH4+ + Cr2O72- P4+ Cr3+ (2) CuO + NH3 Cu + N2 (3) Zn + SCN- Zn2+ + H2S + HCN (4) Fe + NO2- FeO22- + NH3 (5) N2H4 + Cu(OH)2 N2 + Cu 16

3.有机物的氧化还原反应的配平法 。 有机物中一些元素的氧化数较难计算, 可通过比较反应前 后有机物中H、O原子数的变化来配平 >步骤:C2H5OH+O2 CH3CHO+HO √确定还原剂(有机物)和氧化剂 √根据有机物反应前后H、O原子数变化,转换成氧化数变化 C2HsOH->CH3CHO 少两个H,相当于多一个O,可看作氧化数变化为2×2 02H20 对02可看作氧化数变化为4 √由氧化数变化值相等来配平 2C2HsOH+O22CH3CHO 2H2O 17
3. 有机物的氧化还原反应的配平法 • 有机物中一些元素的氧化数较难计算,可通过比较反应前 后有机物中H、O原子数的变化来配平 步骤: 确定还原剂(有机物)和氧化剂 根据有机物反应前后H、O原子数变化,转换成氧化数变化 少两个H,相当于多一个O,可看作氧化数变化为2 对O2可看作氧化数变化为4 由氧化数变化值相等来配平 17 2
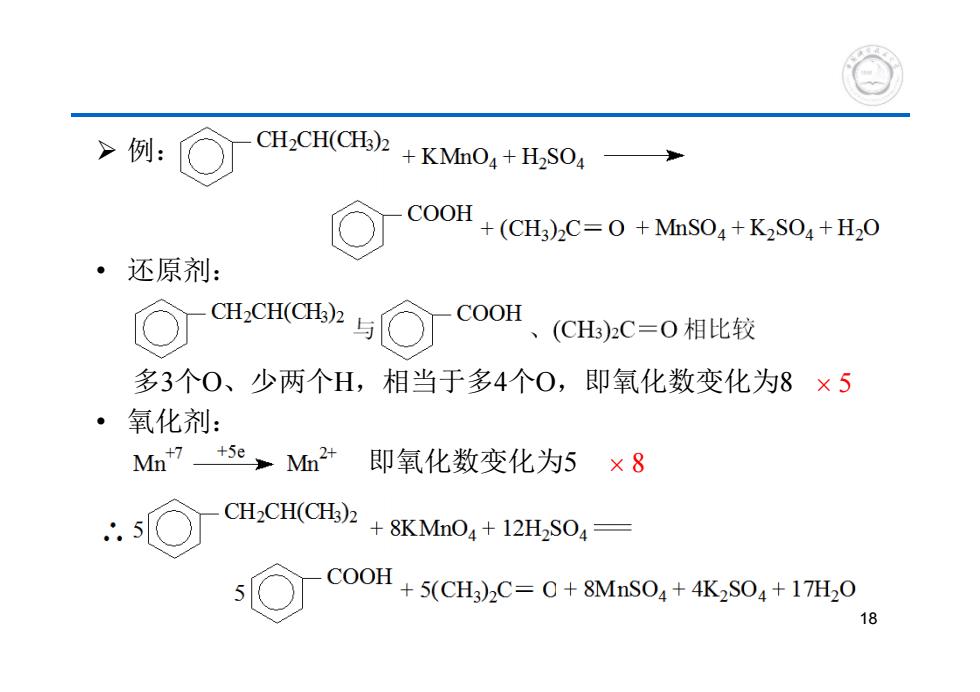
>例: CH2CH(CH)2+KMnO+H2SO4 COOH+(CH)C=0+MnSO+K2SO+H2o 还原剂: CH2CH(CH3)2 COOH 、(CH)2C=O相比较 多3个0、少两个H,相当于多4个0,即氧化数变化为8×5 氧化剂: Mn 7+se,Mn2+即氧化数变化为5 ×8 CH2CH(CH)2 +8KMnO+12H2SOA- C00H+5(CH)2C=0+8Mns04+4K2S04+17H,0 18
例: • 还原剂: 多3个O、少两个H,相当于多4个O,即氧化数变化为8 • 氧化剂: 即氧化数变化为5 18 5 8

§5.2电极电势(Electrode Potential)) 一、法拉第电解定律(Faraday's Electrolysis Laws) >第一电解定律:电解时,在电极上产生物质的质量(m)与 通过电解池的电量(Q=)成正比 m=K·Q=K.It 比例常数K:电化当量 >第二电解定律:每通过96500库仑的电量,就有1个克当量 的任何离子淀积到电极上 √1mol电子电量为6.022×1023×1.602×10-19≈96500(C)=1F √1个克当量:其质量为1mol离子质量除以接受或给出电子 的摩尔数值n(即:氧化数的改变量) √当Q=1F,相当于在电解过程中每接受或给出1ol电子时 变化的物质的质量,称为一个克当量(量纲:克mo?) 克当量:M=KF或者K=M 即m=」 O n .F n F 19
一、法拉第电解定律 (Faraday’s Electrolysis Laws ) 第一电解定律:电解时,在电极上产生物质的质量 ( m ) 与 通过电解池的电量 ( Q = It )成正比 第二电解定律:每通过96500库仑的电量,就有 1 个克当量 的任何离子淀积到电极上 1mol 电子电量为6.022 1023 1.602 10 19 96500 (C) = 1 F 1个克当量:其质量为1 mol离子质量除以接受或给出电子 的摩尔数值 n(即:氧化数的改变量) 当 Q = 1 F,相当于在电解过程中每接受或给出1mol电子时 变化的物质的质量,称为一个克当量(量纲:克/mol? ) 19 §5.2 电极电势 (Electrode Potential) m K Q K I t 比例常数 K:电化当量 F F F Q n M m n M K K n M 克当量: 或者 即

>例如:不同电荷离子电解的克当量 1mol mass of Unit Mass of Cathode reactions Charge(O) electrolysis products Charge electrolysis products Nat+e→Na 1mol e- 23.0g 23.0g Mg2++2e-→Mg 2mol e- 24.30g Imol e 12.15g Al3++3e→A1 3mol e- 27.0g 9.0g 。 克当量在数值上等于该物质的氧化-还原当量(即氧化/还 原剂的分子量除以其在反应中氧化数的改变量) >例如:KMnO,在不同反应中还原产物为K2MnO4,MnO2,Mn+ 的氧化-还原当量 1578=157.81578=52.6 157.8 =31.56 7-6 7-4 7-2 >电解过程中,当一个法拉第电量(1F)通过电解槽时 √阳极(anode):发生氧化反应,产生一个克当量的氧化产物 √阴极(cathode):发生还原反应,产生一个克当量的还原产物
例如:不同电荷离子电解的克当量 • 克当量在数值上等于该物质的氧化-还原当量(即氧化/还 原剂的分子量除以其在反应中氧化数的改变量) 例如:KMnO4在不同反应中还原产物为K2MnO4, MnO2, Mn2+ 的氧化-还原当量 电解过程中,当一个法拉第电量(1 F)通过电解槽时 阳极(anode):发生氧化反应,产生一个克当量的氧化产物 阴极(cathode):发生还原反应,产生一个克当量的还原产物 Cathode reactions Charge (Q) 1mol mass of electrolysis products Unit Charge Mass of electrolysis products Na+ + e Na 1mol e 23.0 g 23.0 g Mg2+ + 2e Mg 2mol e 24.30 g 1mol e 12.15 g Al3+ + 3e Al 3mol e 27.0 g 9.0 g 31.56 7 2 157.8 52.6 7 4 157.8 157.8 7 6 157.8