
无机化学 (Inorganic Chemistry) 课程编号: 开课学期:第一学期 本课程课内总学时:48 学分:4 一、教学对象 应用化学、化学工程与工艺、环境工程、材料化学等专业本科生。 二、教学目的 无机化学是大学各类化学相关专业的第一门重要的基础课,在学习中 起着承前启后的作用。其教学任务和目的是: 1.让学生掌握元素周期律;初步掌握化学热力学、化学动力学、物质结 构、化学平衡、配位平衡以及电化学基础等基本化学原理。并具有对一般 无机化学问题进行理论分析和计算的能力,利用参考资料的能力。 2通过系统地向学生授元素无机化学,使学生能进一步地应用无机化 学基本原理(主要是热力学原理及结构原理)去学习元素的单质及其化合物 的存在、制备、性质及反应性的变化规律,从而进一步加深了对无机化学 基本原理的理解,也进一步运用有关原理去研究、讨论、说明、理解、预 测相应的化学事实,从而掌握提出问题、分析问题、解决问题的能力,取 得“纲举目张”的教学效果。 在教学内容上适当地增加一些与当今世界密切相关的环境科学、生命科 学、能源及材料科学的内容,扩大学生知识面,使学生感受到化学对社会 发展与进步的作用从而增强作为化学工作者的使命感与责任感。 3.通过教学帮助学生树立初步的辩证唯物主义和历史唯物主义的观点: 注意培养学生的科学思维能力。 4.教学中要重视讲授重要元素的单质及其化合物的性质、结构和用途
1 无 机 化 学 (Inorganic Chemistry) 课程编号: 开课学期:第一学期 本课程课内总学时:48 学分:4 一、教学对象 应用化学、化学工程与工艺、环境工程、材料化学等专业本科生。 二、教学目的 无机化学是大学各类化学相关专业的第一门重要的基础课,在学习中 起着承前启后的作用。其教学任务和目的是: 1.让学生掌握元素周期律;初步掌握化学热力学、化学动力学、物质结 构、化学平衡、配位平衡以及电化学基础等基本化学原理。并具有对一般 无机化学问题进行理论分析和计算的能力,利用参考资料的能力。 2.通过系统地向学生讲授元素无机化学,使学生能进一步地应用无机化 学基本原理(主要是热力学原理及结构原理)去学习元素的单质及其化合物 的存在、制备、性质及反应性的变化规律,从而进一步加深了对无机化学 基本原理的理解,也进一步运用有关原理去研究、讨论、说明、理解、预 测相应的化学事实,从而掌握提出问题、分析问题、解决问题的能力,取 得“纲举目张”的教学效果。 在教学内容上适当地增加一些与当今世界密切相关的环境科学、生命科 学、能源及材料科学的内容,扩大学生知识面,使学生感受到化学对社会 发展与进步的作用从而增强作为化学工作者的使命感与责任感。 3.通过教学帮助学生树立初步的辩证唯物主义和历史唯物主义的观点; 注意培养学生的科学思维能力。 4.教学中要重视讲授重要元素的单质及其化合物的性质、结构和用途
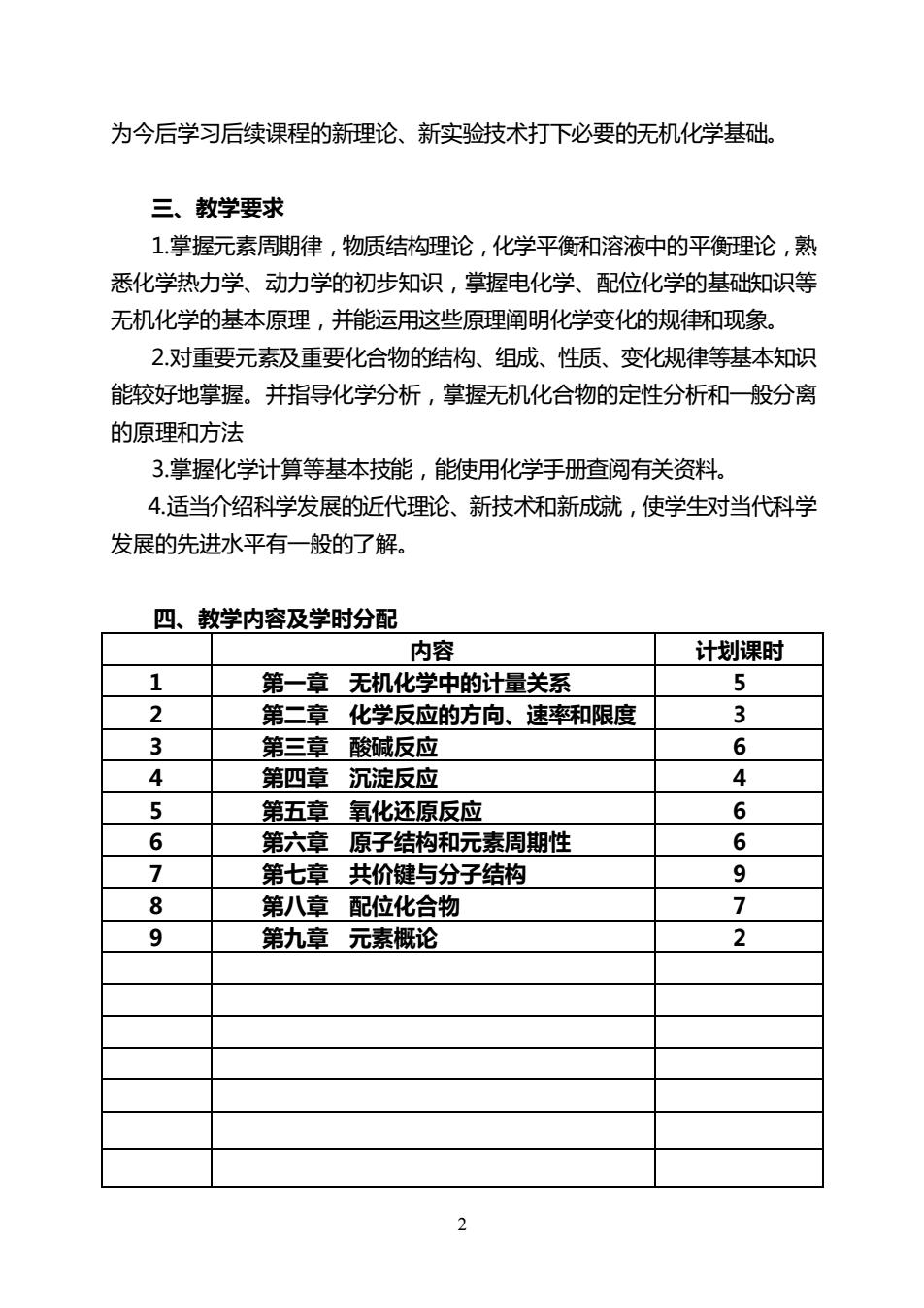
为今后学习后续课程的新理论、新实验技术打下必要的无机化学基础。 三、教学要求 1.掌握元素周期律,物质结构理论,化学平衡和溶液中的平衡理论,熟 悉化学热力学、动力学的初步知识,掌握电化学、配位化学的基础知识等 无机化学的基本原理,并能运用这些原理阐明化学变化的规律和现象。 2.对重要元素及重要化合物的结构、组成、性质、变化规律等基本知识 能较好地掌握。并指导化学分析,掌握无机化合物的定性分析和一般分离 的原理和方法 3.掌握化学计算等基本技能,能使用化学手册查阅有关资料 4.适当介绍科学发展的近代理论、新技术和新成就,使学生对当代科学 发展的先进水平有一般的了解。 四、教学内容及学时分配 内容 计划课时 1 第一章无机化学中的计量关系 5 2 第二章化学反应的方向、速率和限度 3 3 第三章酸碱反应 6 4 第四章沉淀反应 4 5 第五章氧化还原反应 6 6 第六章原子结构和元素周期性 6 7 第七章共价键与分子结构 9 8 第八章配位化合物 7 9 第九章元素概论 2
2 为今后学习后续课程的新理论、新实验技术打下必要的无机化学基础。 三、教学要求 1.掌握元素周期律,物质结构理论,化学平衡和溶液中的平衡理论,熟 悉化学热力学、动力学的初步知识,掌握电化学、配位化学的基础知识等 无机化学的基本原理,并能运用这些原理阐明化学变化的规律和现象。 2.对重要元素及重要化合物的结构、组成、性质、变化规律等基本知识 能较好地掌握。并指导化学分析,掌握无机化合物的定性分析和一般分离 的原理和方法 3.掌握化学计算等基本技能,能使用化学手册查阅有关资料。 4.适当介绍科学发展的近代理论、新技术和新成就,使学生对当代科学 发展的先进水平有一般的了解。 四、教学内容及学时分配 内容 计划课时 1 第一章 无机化学中的计量关系 5 2 第二章 化学反应的方向、速率和限度 3 3 第三章 酸碱反应 6 4 第四章 沉淀反应 4 5 第五章 氧化还原反应 6 6 第六章 原子结构和元素周期性 6 7 第七章 共价键与分子结构 9 8 第八章 配位化合物 7 9 第九章 元素概论 2

第一章无机化学中的计量关系教学要求 1.掌握溶液浓度的表示方法。 2.掌握理想气体状态方程及其应用、分压定律和扩散定律。 3.了解实际气体状态方程、气体分子运动论。 4.通过对这些概念发展过程的学习,注意培养学生的逻辑思维能力: 教学内容 1.溶液组成标度 2.理想气体状态方程: 3.混合气体分压定律,气体扩散定律; 4.*实际气体状态方程; 5.*气体分子的速率分布和能量分布。 教学重点 想气体状态方程及其应用,分压定律和扩散定律。 教学难点 气体分子运动论。 第二章化学反应的方向、速率和限度 教学要求 1.理解状态函数的特性。 2.掌握焓和焓变的概念、吉布斯自由能和熵及它们的变化的初步概念 3.掌握盖斯定律,能运用有关数据进行标准状态下反应的焓变、熵变 和自由能变的计算及初步应用。 4.学会用吉布斯自由能变化去判断化学反应方向。 5.根据吉布斯—亥姆霍兹公式理解AGm与△Hm及△Sm的关系, 并会用于分析温度对化学反应自发性的影响。 教学内容 1.有关热力学的几个常用术语。 2.热力学第一定律和热化学:焓及焓变,反应热和热化学方程式,盖 斯定律,几种热效应。 3.化学反应的方向:反应的自发性,熵的初步概念,吉布斯自由能
3 第一章 无机化学中的计量关系教学要求 1.掌握溶液浓度的表示方法。 2.掌握理想气体状态方程及其应用、分压定律和扩散定律。 3.了解实际气体状态方程、气体分子运动论。 4.通过对这些概念发展过程的学习,注意培养学生的逻辑思维能力。 教学内容 1.溶液组成标度。 2.理想气体状态方程; 3.混合气体分压定律,气体扩散定律; 4.*实际气体状态方程; 5.*气体分子的速率分布和能量分布。 教学重点 想气体状态方程及其应用,分压定律和扩散定律。 教学难点 气体分子运动论。 第二章 化学反应的方向、速率和限度 教学要求 1.理解状态函数的特性。 2.掌握焓和焓变的概念、吉布斯自由能和熵及它们的变化的初步概念。 3.掌握盖斯定律,能运用有关数据进行标准状态下反应的焓变、熵变 和自由能变的计算及初步应用。 4.学会用吉布斯自由能变化去判断化学反应方向。 5.根据吉布斯——亥姆霍兹公式理解Δ rGm与Δ rHm及Δ rSm的关系, 并会用于分析温度对化学反应自发性的影响。 教学内容 1.有关热力学的几个常用术语。 2.热力学第一定律和热化学:焓及焓变,反应热和热化学方程式,盖 斯定律,几种热效应。 3.化学反应的方向:反应的自发性,熵的初步概念,吉布斯自由能

4.吉布斯—亥姆霍兹公式。 教学重点 掌握热力学第一定律及它对恒压只做体积功、恒容只做体积功过程的 应用:盖斯定律及计算化学反应热的计算;吉布斯自由能变化公Gm与化学 反应方向的判断。 教学难点 状态函数,反应热的计算,吉布斯自由能,化学反应方向的判断。 教学要求 1.掌握反应速率的意义及速率方程表达式。 2.了解反应速率的碰撞理论和过渡状态理论 3.了解基元反应、复杂反应、反应级数、活化能等概念 4.掌握浓度、温度及催化剂对化学反应速率的影响。 5.了解速度方程的实验测定和阿累尼乌斯公式的有关计算 6.了解活化能的概念及其与化学反应速率的关系。 教学内容 1.化学反应速率的概念。 2.浓度对化学反应速率影响 一速度方程。 3.温度对化学反应速率的影响—阿累尼乌斯公式与活化能。 4.反应速率理论和反应机理简介。 5.催化剂和催化作用。 教学重点 Arrhenius经验公式与活化能和速率常数的计算,浓度、温度、催化剂 对反应速率的影响 教学难点 反应级数,影响化学反应速率的因素! 教学要求 1.了解化学平衡的概念,理解平衡常数的意义。 2.掌握有关化学平衡的计算。 3.熟悉有关化学平衡移动原理
4 4.吉布斯——亥姆霍兹公式。 教学重点 掌握热力学第一定律及它对恒压只做体积功、恒容只做体积功过程的 应用;盖斯定律及计算化学反应热的计算;吉布斯自由能变化Δ rGm与化学 反应方向的判断。 教学难点 状态函数,反应热的计算,吉布斯自由能,化学反应方向的判断。 教学要求 1.掌握反应速率的意义及速率方程表达式。 2.了解反应速率的碰撞理论和过渡状态理论。 3.了解基元反应、复杂反应、反应级数、活化能等概念。 4.掌握浓度、温度及催化剂对化学反应速率的影响。 5.了解速度方程的实验测定和阿累尼乌斯公式的有关计算。 6.了解活化能的概念及其与化学反应速率的关系。 教学内容 1.化学反应速率的概念。 2.浓度对化学反应速率影响——速度方程。 3.温度对化学反应速率的影响——阿累尼乌斯公式与活化能。 4.反应速率理论和反应机理简介。 5.催化剂和催化作用。 教学重点 Arrhenius 经验公式与活化能和速率常数的计算,浓度、温度、催化剂 对反应速率的影响。 教学难点 反应级数,影响化学反应速率的因素。 教学要求 1.了解化学平衡的概念,理解平衡常数的意义。 2.掌握有关化学平衡的计算。 3.熟悉有关化学平衡移动原理

4.了解化学反应等温式的含义,了解其相关的计算与应用。 5.利用函数△Gm°或AG判断标准态及非标准态下化学反应的方向 性。 教学内容 1.可逆反应和化学平衡。 2.平衡常数:化学平衡定律,平衡常数的物理意义。 3.有关化学平衡的计算。 4.化学平衡的移动:浓度、压力、温度对化学平衡的影响,化学反应 等温式,勒夏特里原理。 教学重点 化学反应方向的判据,化学平衡的移动。 教学难点 平衡常数Ke与吉布斯自由能(△,Gm。)的关系及相关计算,Van't Hoff 方程△,G=△,Gm°+RTInQ的应用 第三章酸碱平衡 教学要求 1.了解酸碱理论发展概况。 2.掌握溶液酸度的概念和PH值的意义,熟悉PH与H+]的相互换算。 3.掌握弱电解质的电离平衡,及影响电离平衡移动的因素,熟练掌握 有关离子浓度的计算。 4.掌握缓冲溶液的组成、缓冲作用原理、缓冲溶液pH的值计算。 5.掌握各类盐的水解平衡及盐溶液pH值的计算。 教学内容 1,酸碱理论:酸碱的电离理论,酸碱质子理论。 2.水的电离及离子积常数,溶液的酸度及p州值,拉平效应和区分效 应。 3.弱酸、弱碱的电离平衡,电离常数和电离度。 4.缓冲溶液的组成、缓冲作用原理和缓冲溶液的pH值。 5.盐类水解和盐溶液的pH值。 5
5 4.了解化学反应等温式的含义,了解其相关的计算与应用。 5.利用函数Δ rGm ө 或Δ rG 判断标准态及非标准态下化学反应的方向 性。 教学内容 1.可逆反应和化学平衡。 2.平衡常数:化学平衡定律,平衡常数的物理意义。 3.有关化学平衡的计算。 4.化学平衡的移动:浓度、压力、温度对化学平衡的影响,化学反应 等温式,勒夏特里原理。 教学重点 化学反应方向的判据,化学平衡的移动。 教学难点 平衡常数 Kө与吉布斯自由能(ΔrGm ө)的关系及相关计算,Van’t Hoff 方程 ΔrG=ΔrGm ө +RTln Q 的应用 第三章 酸碱平衡 教学要求 1.了解酸碱理论发展概况。 2.掌握溶液酸度的概念和 PH 值的意义,熟悉 PH 与[H+]的相互换算。 3.掌握弱电解质的电离平衡,及影响电离平衡移动的因素,熟练掌握 有关离子浓度的计算。 4.掌握缓冲溶液的组成、缓冲作用原理、缓冲溶液 pH 的值计算。 5.掌握各类盐的水解平衡及盐溶液 pH 值的计算。 教学内容 1.酸碱理论:酸碱的电离理论,酸碱质子理论。 2.水的电离及离子积常数,溶液的酸度及 pH 值,拉平效应和区分效 应。 3.弱酸、弱碱的电离平衡,电离常数和电离度。 4.缓冲溶液的组成、缓冲作用原理和缓冲溶液的 pH 值。 5.盐类水解和盐溶液的 pH 值