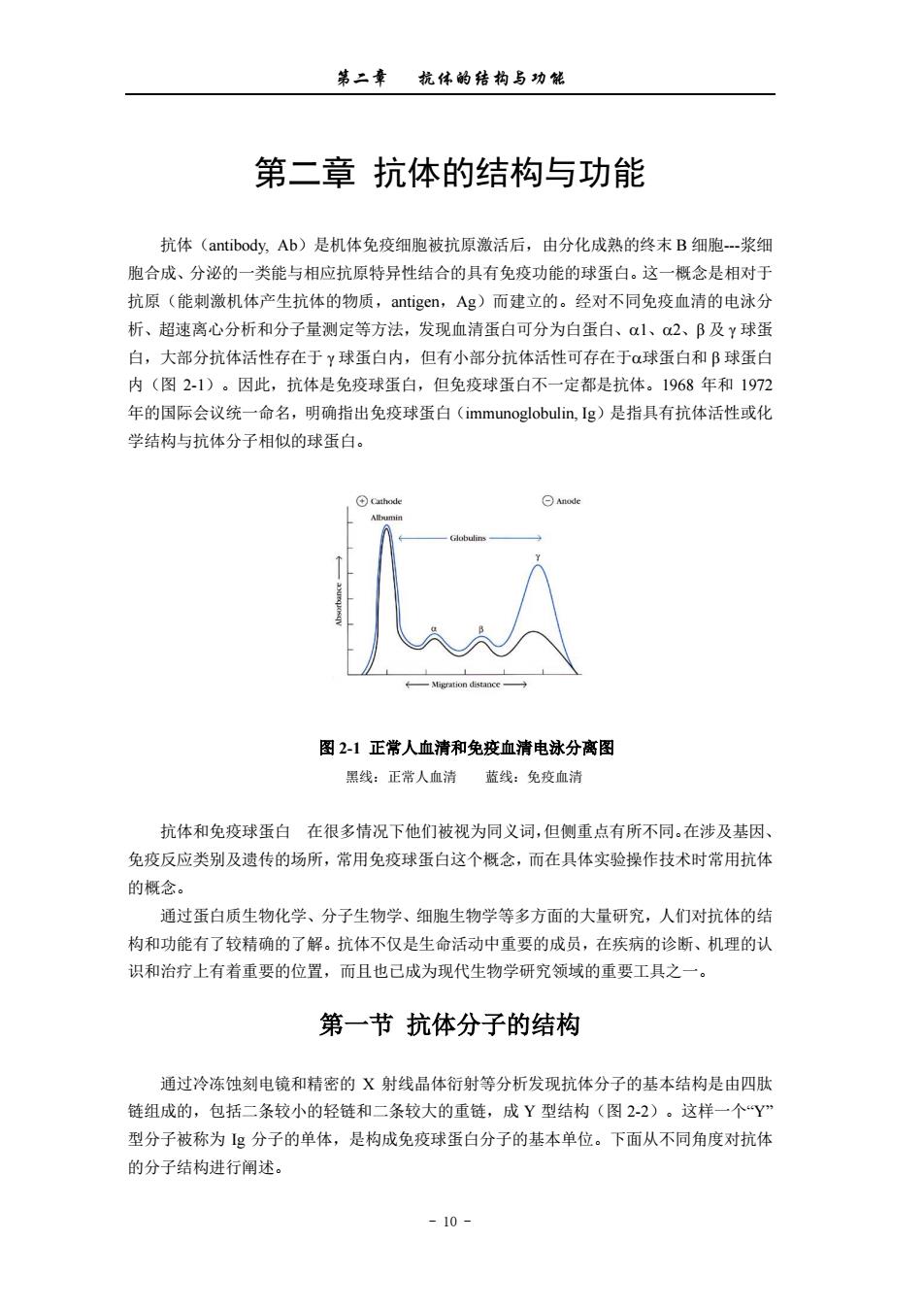
第二章杭体的结构与功能 第二章抗体的结构与功能 抗体(antibody,.Ab)是机体免疫细胞被抗原激活后,由分化成熟的终末B细胞-浆细 胞合成、分泌的一类能与相应抗原特异性结合的具有免疫功能的球蛋白。这一概念是相对于 抗原(能刺激机体产生抗体的物质,antigen,Ag)而建立的。经对不同免疫血清的电泳分 析、超速离心分析和分子量测定等方法,发现血清蛋白可分为白蛋白、1、a2、B及Y球蛋 白,大部分抗体活性存在于Y球蛋白内,但有小部分抗体活性可存在于α球蛋白和B球蛋白 内(图2-1)。因此,抗体是免疫球蛋白,但免疫球蛋白不一定都是抗体。1968年和1972 年的国际会议统一命名,明确指出免疫球蛋白(immunoglobulin,.Ig)是指具有抗体活性或化 学结构与抗体分子相似的球蛋白。 图21正常人血清和免疫血清电泳分离图 黑线:正常人血清监线:免疫血清 抗体和免疫球蛋白在很多情况下他们被视为同义词,但侧重点有所不同.在涉及基因、 免疫反应类别及遗传的场所,常用免疫球蛋白这个概念,而在具体实验操作技术时常用抗体 的概念。 通过蛋白质生物化学、分子生物学、细胞生物学等多方面的大量研究,人们对抗体的结 构和功能有了较精确的了解。抗体不仅是生命活动中重要的成员,在疾病的诊断、机理的认 识和治疗上有重要的位置,而且也己成为现代生物学研究领域的重要工具之一。 第一节抗体分子的结构 通过冷冻蚀刻电镜和精密的X射线晶体衍射等分析发现抗体分子的基本结构是由四 链组成的,包括二条较小的轻链和二条较大的重链,成Y型结构(图2-2)。这样一个“Y” 型分子被称为g分子的单体,是构成免疫球蛋白分子的基本单位。下面从不同角度对抗体 的分子结构进行阐述。 -10
第二章 抗体的结构与功能 - 10 - 第二章 抗体的结构与功能 抗体(antibody, Ab)是机体免疫细胞被抗原激活后,由分化成熟的终末 B 细胞-浆细 胞合成、分泌的一类能与相应抗原特异性结合的具有免疫功能的球蛋白。这一概念是相对于 抗原(能刺激机体产生抗体的物质,antigen,Ag)而建立的。经对不同免疫血清的电泳分 析、超速离心分析和分子量测定等方法,发现血清蛋白可分为白蛋白、1、2、β 及 γ 球蛋 白,大部分抗体活性存在于 γ 球蛋白内,但有小部分抗体活性可存在于球蛋白和 β 球蛋白 内(图 2-1)。因此,抗体是免疫球蛋白,但免疫球蛋白不一定都是抗体。1968 年和 1972 年的国际会议统一命名,明确指出免疫球蛋白(immunoglobulin, Ig)是指具有抗体活性或化 学结构与抗体分子相似的球蛋白。 图 2-1 正常人血清和免疫血清电泳分离图 黑线:正常人血清 蓝线:免疫血清 抗体和免疫球蛋白 在很多情况下他们被视为同义词,但侧重点有所不同。在涉及基因、 免疫反应类别及遗传的场所,常用免疫球蛋白这个概念,而在具体实验操作技术时常用抗体 的概念。 通过蛋白质生物化学、分子生物学、细胞生物学等多方面的大量研究,人们对抗体的结 构和功能有了较精确的了解。抗体不仅是生命活动中重要的成员,在疾病的诊断、机理的认 识和治疗上有着重要的位置,而且也已成为现代生物学研究领域的重要工具之一。 第一节 抗体分子的结构 通过冷冻蚀刻电镜和精密的 X 射线晶体衍射等分析发现抗体分子的基本结构是由四肽 链组成的,包括二条较小的轻链和二条较大的重链,成 Y 型结构(图 2-2)。这样一个“Y” 型分子被称为 Ig 分子的单体,是构成免疫球蛋白分子的基本单位。下面从不同角度对抗体 的分子结构进行阐述
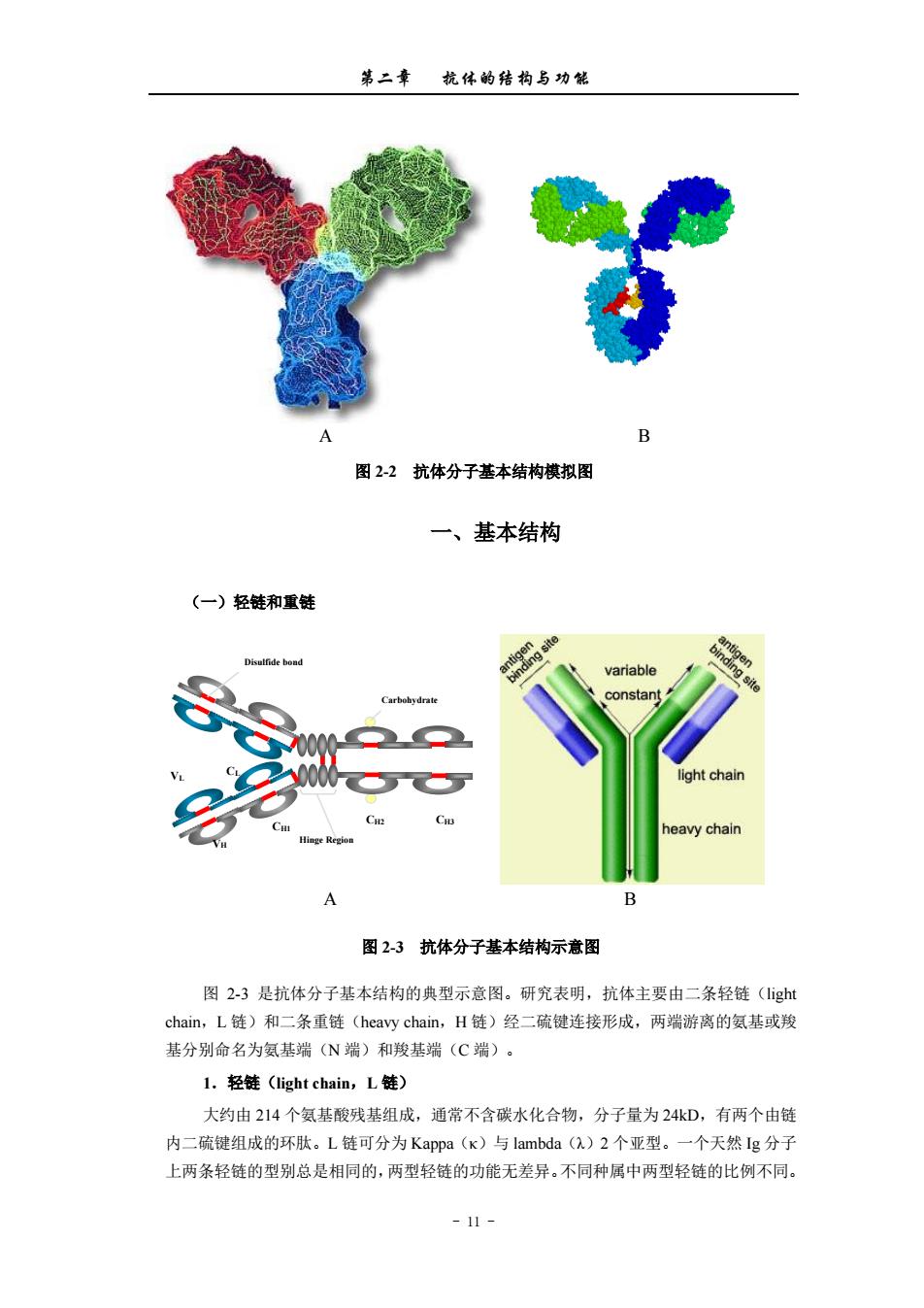
第二章杭体的结构与功能 图2-2抗体分子基本结构模拟图 一、基本结构 (一)轻链和重链 A 图23抗体分子基本结构示意图 图2-3是抗体分子基本结构的典型示意图。研究表明,抗体主要由二条轻链(gh chain,L链)和二条重链(heavy chain,H链)经二硫健连接形成,两端游离的氨基或羧 基分别命名为氨基端(N端)和羧基端(C端) 1.轻链((light chain,L链) 大约由214个氨基酸残基组成,通常不含碳水化合物,分子量为24kD,有两个由剑 内二硫键组成的环肽。L链可分为Kappa(K)与lambda(2)2个亚型。一个天然Ig分子 上两条轻链的型别总是相同的,两型轻链的功能无差异。不同种属中两型轻链的比例不同。 -11-
第二章 抗体的结构与功能 - 11 - A B 图 2-2 抗体分子基本结构模拟图 一、基本结构 (一)轻链和重链 A B 图 2-3 抗体分子基本结构示意图 图 2-3 是抗体分子基本结构的典型示意图。研究表明,抗体主要由二条轻链(light chain,L 链)和二条重链(heavy chain,H 链)经二硫键连接形成,两端游离的氨基或羧 基分别命名为氨基端(N 端)和羧基端(C 端)。 1.轻链(light chain,L 链) 大约由 214 个氨基酸残基组成,通常不含碳水化合物,分子量为 24kD,有两个由链 内二硫键组成的环肽。L 链可分为 Kappa(κ)与 lambda(λ)2 个亚型。一个天然 Ig 分子 上两条轻链的型别总是相同的,两型轻链的功能无差异。不同种属中两型轻链的比例不同。 CH1 VL CL VH CH2 CH3 Hinge Region Carbohydrate Disulfide bond

第二章杭保的结构与功能 正常人血清免疫球蛋白K:入约为2:1,而在小鼠则为20:1。K:入比例的异常可能反映 免疫系统的异常,例如人类免疫球蛋白入链过多提示可能有产生入链的B细胞肿瘤。 2.重链(heavy chain,H链) 重链大小约为轻链的2倍,大约由450-550个氨基酸残基组成,分子量55-75kD,含 糖数量不同。每条H链含有4~5个链内二硫键所组成的环肽。不同H链由于氨基酸组成 的排列顺序、二硫键的数目和位置、含的种类和数量不同,其抗原性也不相同。根据H 链抗原性的差异可将其分为5类:μ链、Y链、a链、δ链和ε链。不同H链与L链(K或 入链)组成完整g的分子分别称之为gM、gG、IgA、lgD和gE。Ya和8链上含有4 个环肽,u和£链含有5个环肽: 所有重链都可以表达成两种分子型式:分泌型和膜型。这两种分子的区别在于最后 一个重链恒定区功能区的近羧基端氨基酸序列的不同。所有的重链也都有糖基化的N端, 即含有与天冬氨酸侧链相连的寡糖基团。不同的g的寡糖位置变化很大。寡糖的精确构 成并非完全取决于多肽序列,可能随抗体分子所处时的生理状态不同而有所不同。 (二)可变区和恒定区 通过对H链或L链的氨基酸序列比较分析,发现其氨基端(N未端)氨基酸序列变 化很大,称此区为可变区(Variable region,V区),而羧基端(C-末端)则相对稳定, 变化很小,称此区为恒定区(Constant region,C区) 1.可变区 位于L链靠近N端的12(约含108~111个氨基酸残基)和H链靠近N端的1/5或 14(约含118个氨基酸残基)。每个V区中均有一个由链内二硫键连接形成的肽环,每 个肽环约含67一5个氨基酸残基。V区氨基酸的组成和排列随抗体结合抗原的特异性不 同有较大的变异。由于V区中氨基酸的种类及排列顺序千变万化,故可形成许多种具有 不同结合抗原特异性的抗体 2.恒定区 位于L链靠近C端的12(约含105个氨基酸残基)和H链靠近C端的34区域或 45区域(约从119位氨基酸至C末端)。H链每个功能区约含110多个氨基酸残基,含 有一个由二锍键连接的50~60个氨基酸残基组成的肽环。这个区域氨基酸的组成和排列 在同一种属Ig同型L链和同一类H链中都比较恒定,如人抗白喉外毒素1gG与人抗破伤 风外毒素的gG,它们的V区不相同,只能与相应的抗原发生特异性的结合,但其C区的 结构是相同的,即具有相同的抗原性,应用马抗人gG第二体均能与这两种抗不同外毒素 的抗体(1gG)发生结合反应。这是应用荧光、酶、同位毒等标记抗体(第二抗体)的重 要基础。 (三)超变区和骨架区 比较许多不同抗体的V区氨基酸序列,发现V和V各有三个区域的氨基酸组成和 排列顺序特别易变化。这些可变区域称为超变区(ypervariable region,HVR),分别用 HVR1、HVR2和HVR3表示。VL的HVR在24-34、50-56、89-97氨基酸位置。V的HVR -12-
第二章 抗体的结构与功能 - 12 - 正常人血清免疫球蛋白 κ:λ 约为 2:1,而在小鼠则为 20:1。κ:λ 比例的异常可能反映 免疫系统的异常,例如人类免疫球蛋白 λ 链过多提示可能有产生 λ 链的 B 细胞肿瘤。 2.重链(heavy chain,H 链) 重链大小约为轻链的 2 倍,大约由 450-550 个氨基酸残基组成,分子量 55-75kD,含 糖数量不同。每条 H 链含有 4~5 个链内二硫键所组成的环肽。不同 H 链由于氨基酸组成 的排列顺序、二硫键的数目和位置、含的种类和数量不同,其抗原性也不相同。根据 H 链抗原性的差异可将其分为 5 类:μ 链、γ 链、α 链、δ 链和 ε 链。不同 H 链与 L 链(κ 或 λ 链)组成完整 Ig 的分子分别称之为 IgM、IgG、IgA、IgD 和 IgE。γ、α 和 δ 链上含有 4 个环肽,μ 和 ε 链含有 5 个环肽。 所有重链都可以表达成两种分子型式:分泌型和膜型。这两种分子的区别在于最后 一个重链恒定区功能区的近羧基端氨基酸序列的不同。所有的重链也都有糖基化的 N 端, 即含有与天冬氨酸侧链相连的寡糖基团。不同的 Ig 的寡糖位置变化很大。寡糖的精确构 成并非完全取决于多肽序列,可能随抗体分子所处时的生理状态不同而有所不同。 (二)可变区和恒定区 通过对 H 链或 L 链的氨基酸序列比较分析,发现其氨基端(N-末端)氨基酸序列变 化很大,称此区为可变区(Variable region,V 区),而羧基端(C-末端)则相对稳定, 变化很小,称此区为恒定区(Constant region,C 区)。 1.可变区 位于 L 链靠近 N 端的 1/2(约含 108~111 个氨基酸残基)和 H 链靠近 N 端的 1/5 或 1/4(约含 118 个氨基酸残基)。每个 V 区中均有一个由链内二硫键连接形成的肽环,每 个肽环约含 67~75 个氨基酸残基。V 区氨基酸的组成和排列随抗体结合抗原的特异性不 同有较大的变异。由于 V 区中氨基酸的种类及排列顺序千变万化,故可形成许多种具有 不同结合抗原特异性的抗体。 2.恒定区 位于 L 链靠近 C 端的 1/2(约含 105 个氨基酸残基)和 H 链靠近 C 端的 3/4 区域或 4/5 区域(约从 119 位氨基酸至 C 末端)。H 链每个功能区约含 110 多个氨基酸残基,含 有一个由二锍键连接的 50~60 个氨基酸残基组成的肽环。这个区域氨基酸的组成和排列 在同一种属 Ig 同型 L 链和同一类 H 链中都比较恒定,如人抗白喉外毒素 IgG 与人抗破伤 风外毒素的 IgG,它们的 V 区不相同,只能与相应的抗原发生特异性的结合,但其 C 区的 结构是相同的,即具有相同的抗原性,应用马抗人 IgG 第二体均能与这两种抗不同外毒素 的抗体(IgG)发生结合反应。这是应用荧光、酶、同位毒等标记抗体(第二抗体)的重 要基础。 (三)超变区和骨架区 比较许多不同抗体的 V 区氨基酸序列,发现 VH 和 VL各有三个区域的氨基酸组成和 排列顺序特别易变化。这些可变区域称为超变区(hypervariable region, HVR),分别用 HVR1、HVR2 和 HVR3 表示。VL的 HVR 在 24-34、50-56、89-97 氨基酸位置。VH的 HVR
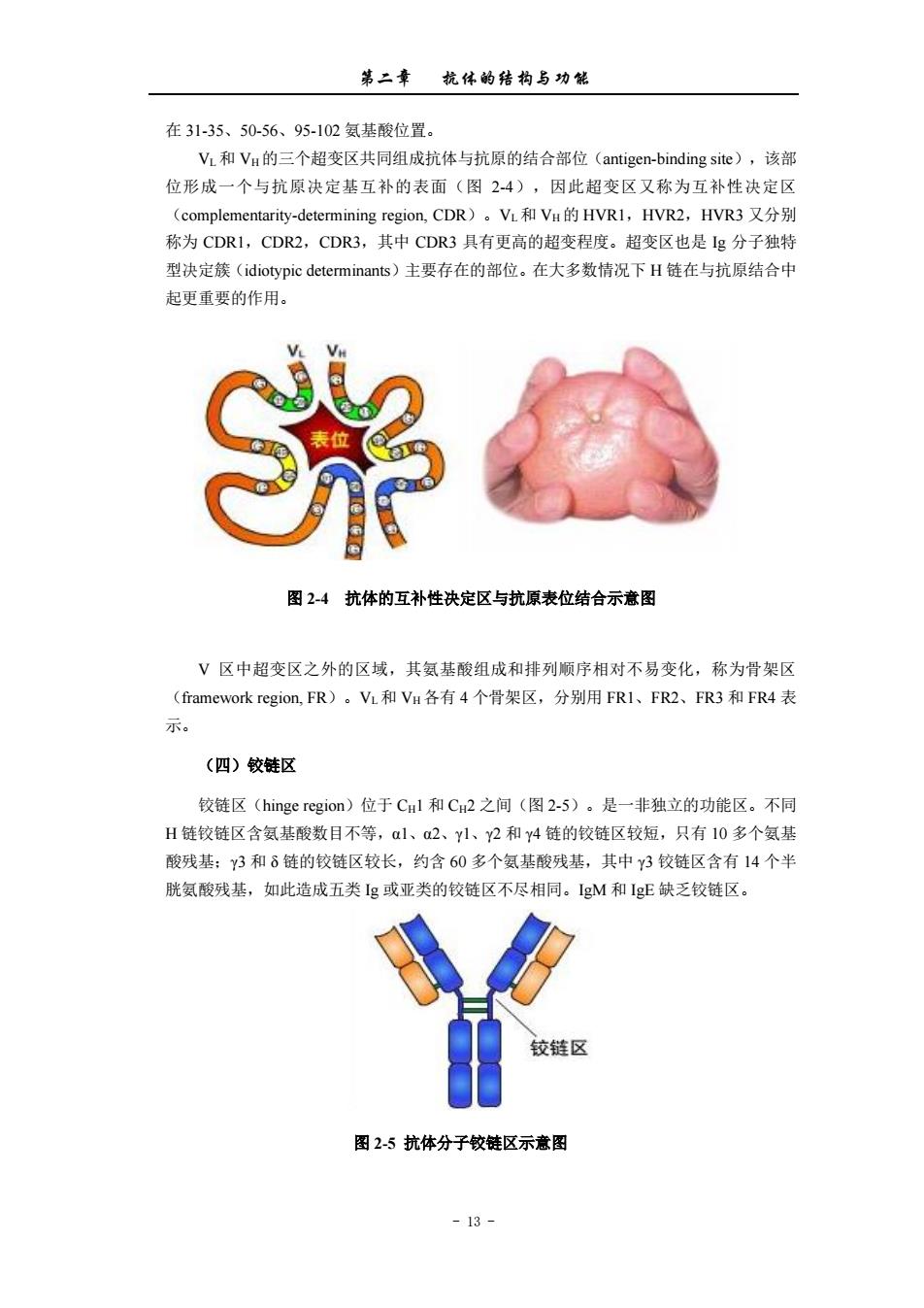
第二章杭体的结物与功能 在31-35、50-56、95-102氨基酸位置。 V,和V,的三个超变风共同组成抗体与抗原的结合部位(antigen-binding site),该部 位形成一个与抗原决定基互补的表面(图24),因此超变区又称为互补性决定区 (compmentarity-deteining region,.CDR)。VL和Va的HVRl,HvR2,HVR3又分别 称为CDR1,CDR2,CDR3,其中CDR3具有更高的超变程度。超变区也是Ig分子独特 型决定簇(idiotypic determinants)主要存在的部位。在大多数情况下H链在与抗原结合中 起更重要的作用。 图2-4抗体的互补性决定区与抗原表位结合示意图 V区中超变区之外的区域,其氨基酸组成和排列顺序相对不易变化,称为骨架区 (framework region,FR)。VL和VH各有4个骨架区,分别用FRl、FR2、FR3和FR4表 示。 (四)较链区 铰链区(hinge region)位于CHl和C2之间(图2-5)。是一非独立的功能区。不同 H链较链区含氨基酸数目不等,α1、a2、1、Y2和Y4链的铰链区较短,只有10多个氨基 酸残基:Y3和δ链的较链区较长,约含60多个氨基酸残基,其中Y3较链区含有14个半 胱氨酸残基,如此造成五类Ig或亚类的铰链区不尽相同。IeM和1E缺乏较链区。 铰链区 图2-5抗体分子较链区示意图 -13
第二章 抗体的结构与功能 - 13 - 在 31-35、50-56、95-102 氨基酸位置。 VL和 VH的三个超变区共同组成抗体与抗原的结合部位(antigen-binding site),该部 位形成一个与抗原决定基互补的表面(图 2-4),因此超变区又称为互补性决定区 (complementarity-determining region, CDR)。VL和 VH的 HVR1,HVR2,HVR3 又分别 称为 CDR1,CDR2,CDR3,其中 CDR3 具有更高的超变程度。超变区也是 Ig 分子独特 型决定簇(idiotypic determinants)主要存在的部位。在大多数情况下 H 链在与抗原结合中 起更重要的作用。 图 2-4 抗体的互补性决定区与抗原表位结合示意图 V 区中超变区之外的区域,其氨基酸组成和排列顺序相对不易变化,称为骨架区 (framework region, FR)。VL和 VH 各有 4 个骨架区,分别用 FR1、FR2、FR3 和 FR4 表 示。 (四)铰链区 铰链区(hinge region)位于 CH1 和 CH2 之间(图 2-5)。是一非独立的功能区。不同 H 链铰链区含氨基酸数目不等,α1、α2、γ1、γ2 和 γ4 链的铰链区较短,只有 10 多个氨基 酸残基;γ3 和 δ 链的铰链区较长,约含 60 多个氨基酸残基,其中 γ3 铰链区含有 14 个半 胱氨酸残基,如此造成五类 Ig 或亚类的铰链区不尽相同。IgM 和 IgE 缺乏铰链区。 图 2-5 抗体分子铰链区示意图
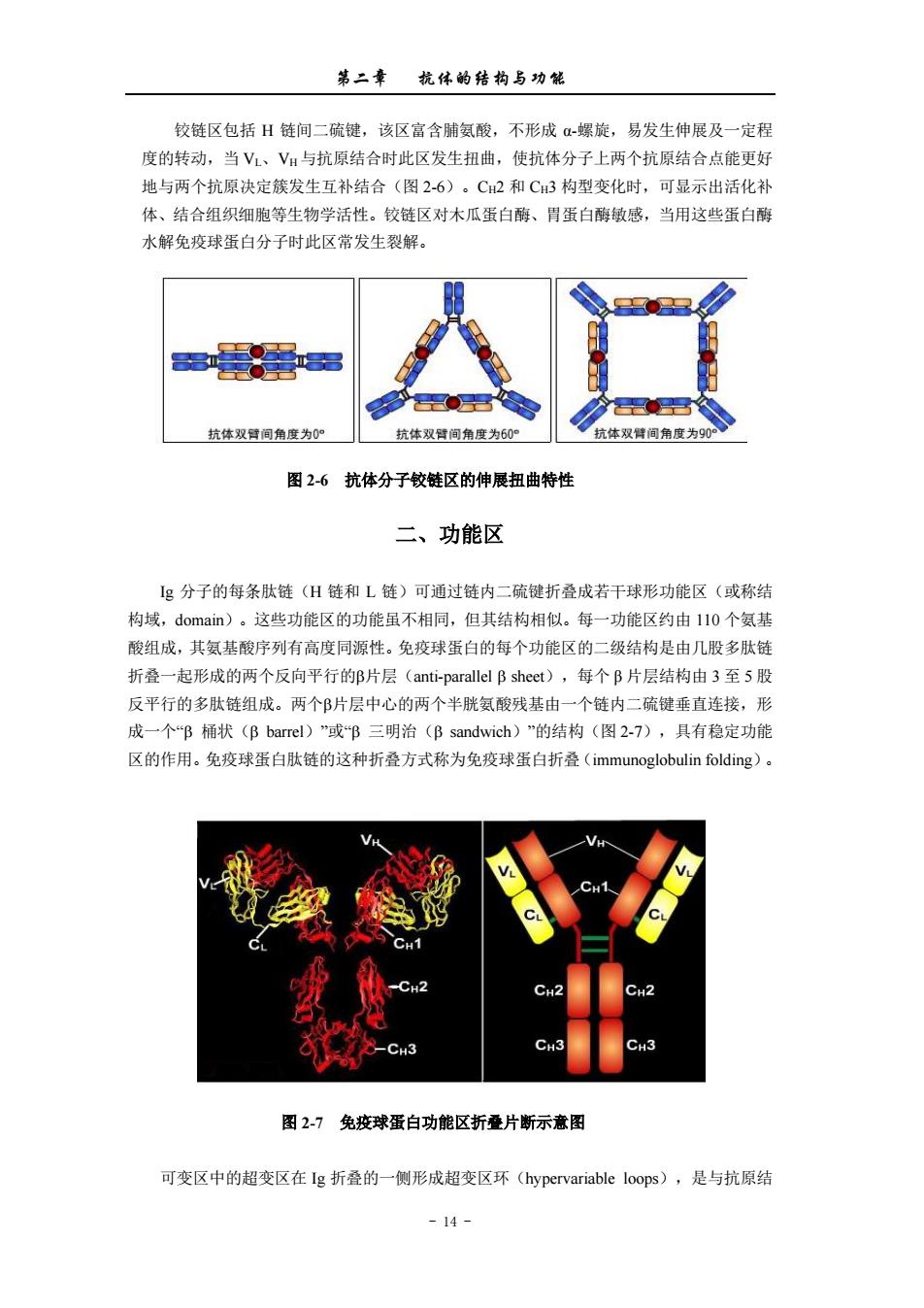
第二章杭保的结构与功能 铰链区包括H链间二硫键,该区高含脯氨酸,不形成α螺旋,易发生伸展及一定程 度的转动,当V、V:与抗原结合时此区发生扭曲,使抗体分子上两个抗原结合点能更好 地与两个抗原决定簇发生互补结合(图2-6)。C2和C3构型变化时,可显示出活化补 体、结合组织细胞等生物学活性。铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶 水解免疫球蛋白分子时此区常发生裂解。 抗体双臂间角度为0 抗体双得间角度为60° 抗体双臂间角度为9 图26抗体分子较链区的伸展扭曲特性 二、功能区 g分子的每条肽链(H链和L链)可通过链内二硫键折叠成若干球形功能区(或称结 构域,domain)。这些功能区的功能虽不相同,但其结构相似。每一功能区约由110个氨基 酸组成,其氨基酸序列有高度同源性。免疫球蛋白的每个功能区的二级结构是由几股多肚 折叠一起形成的两个反向平行的B片层(anti-parallel B sheet),每个B片层结构由3至5股 反平行的多肽链组成。两个β片层中心的两个半胱氨酸残基由一个链内二硫键垂直连接,形 成一个B桶状(B barrel)”或B三明治(B sandwich)”的结构(图2-7),具有稳定功能 区的作用。兔疫球蛋白肽链的这种折叠方式称为免疫球蛋白折叠(immunoglobulin folding)。 图27免疫球蛋白功能区折叠片断示意图 可变区中的超变区在Ig折叠的一侧形成超变区环(hypervariable loops),是与抗原结 -14-
第二章 抗体的结构与功能 - 14 - 铰链区包括 H 链间二硫键,该区富含脯氨酸,不形成 α-螺旋,易发生伸展及一定程 度的转动,当 VL、VH 与抗原结合时此区发生扭曲,使抗体分子上两个抗原结合点能更好 地与两个抗原决定簇发生互补结合(图 2-6)。CH2 和 CH3 构型变化时,可显示出活化补 体、结合组织细胞等生物学活性。铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶 水解免疫球蛋白分子时此区常发生裂解。 图 2-6 抗体分子铰链区的伸展扭曲特性 二、功能区 Ig 分子的每条肽链(H 链和 L 链)可通过链内二硫键折叠成若干球形功能区(或称结 构域,domain)。这些功能区的功能虽不相同,但其结构相似。每一功能区约由 110 个氨基 酸组成,其氨基酸序列有高度同源性。免疫球蛋白的每个功能区的二级结构是由几股多肽链 折叠一起形成的两个反向平行的片层(anti-parallel sheet),每个 β 片层结构由 3 至 5 股 反平行的多肽链组成。两个片层中心的两个半胱氨酸残基由一个链内二硫键垂直连接,形 成一个“ 桶状( barrel)”或“ 三明治( sandwich)”的结构(图 2-7),具有稳定功能 区的作用。免疫球蛋白肽链的这种折叠方式称为免疫球蛋白折叠(immunoglobulin folding)。 图 2-7 免疫球蛋白功能区折叠片断示意图 可变区中的超变区在 Ig 折叠的一侧形成超变区环(hypervariable loops),是与抗原结