
实验:明矾的制备、组成测定 及其用于净化污水 第二组:刘全阳、王木、汤霄 扬、陈丽霞、邓燚
实验:明矾的制备﹑组成测定 及其用于净化污水 第二组:刘全阳﹑王木﹑汤霄 扬﹑陈丽霞﹑邓燚

一、实验目的 。1.了解明矾的制备方法; 。2.测定明矾的组成; 。3.利用明矾净化污水
一、实验目的 1.了解明矾的制备方法; 2.测定明矾的组成; 3.利用明矾净化污水

二、明矾的制备 1,用碱 (1)原理 铝屑溶于浓氢氧化钠溶液,可生成可溶性的四羟基合铝(Ⅱ) 酸钠 Na[AI(OH)4],再用稀H2SO4调节溶液的pH值,将其转化为氢氧化铝, 使氢氧化铝溶于硫酸生成硫酸铝。硫酸铝能同碱金属硫酸盐如硫酸钾 在水溶液中结合成一类在水中溶解度较小的同晶的复盐,此复盐称为 明矾[KAI(SO4)212H2O]。当冷却溶液时,明矾则以大块晶体结晶 出来
二、明矾的制备 1.用碱 (1)原理 铝屑溶于浓氢氧化钠溶液,可生成可溶性的四羟基合铝(Ⅲ)酸钠 Na[Al(OH)4],再用稀H2SO4调节溶液的pH值,将其转化为氢氧化铝, 使氢氧化铝溶于硫酸生成硫酸铝。硫酸铝能同碱金属硫酸盐如硫酸钾 在水溶液中结合成一类在水中溶解度较小的同晶的复盐,此复盐称为 明矾[KAl(SO4)2·12H2O]。当冷却溶液时,明矾则以大块晶体结晶 出来

制备中的化学反应如下: 2Al+2NaOH+6H,O===2Na[Al(OH)]+3H21 2Na[Al(OH)]+H2SO=--2Al(OH)3+Na2SO+2H2O 2AI(OH)3+3H2S04==Al2(S04)3+6H20 Al2(S04)3+K2S04+24H20==2KA1(S04)212H20 (2)实验仪器与试剂 。烧杯,量筒,普通漏斗,布氏漏斗,抽滤瓶,表面皿,蒸发皿, 酒精灯,台秤,毛细管,提勒管等。 H2S04(3molL-1),Na0H(s),K2S04(s,铝屑,pH浅纸 1~14)
制备中的化学反应如下: 2Al + 2NaOH + 6H2O ===2Na[Al(OH) 4] + 3H2↑ 2Na[Al(OH) 4] + H2SO4 ===2Al(OH) 3↓+ Na2SO4 + 2H2O 2Al(OH) 3 + 3H2SO4 === Al2(SO4) 3 + 6 H2O Al2(SO4) 3 + K2SO4 + 24H2O ===2KAl(SO4) 2·12H2O (2)实验仪器与试剂 烧杯,量筒,普通漏斗,布氏漏斗,抽滤瓶,表面皿,蒸发皿, 酒精灯,台秤,毛细管,提勒管等。 H2SO4(3mol·L-1),NaOH(s),K2SO4(s),铝屑,pH试纸( 1~14)
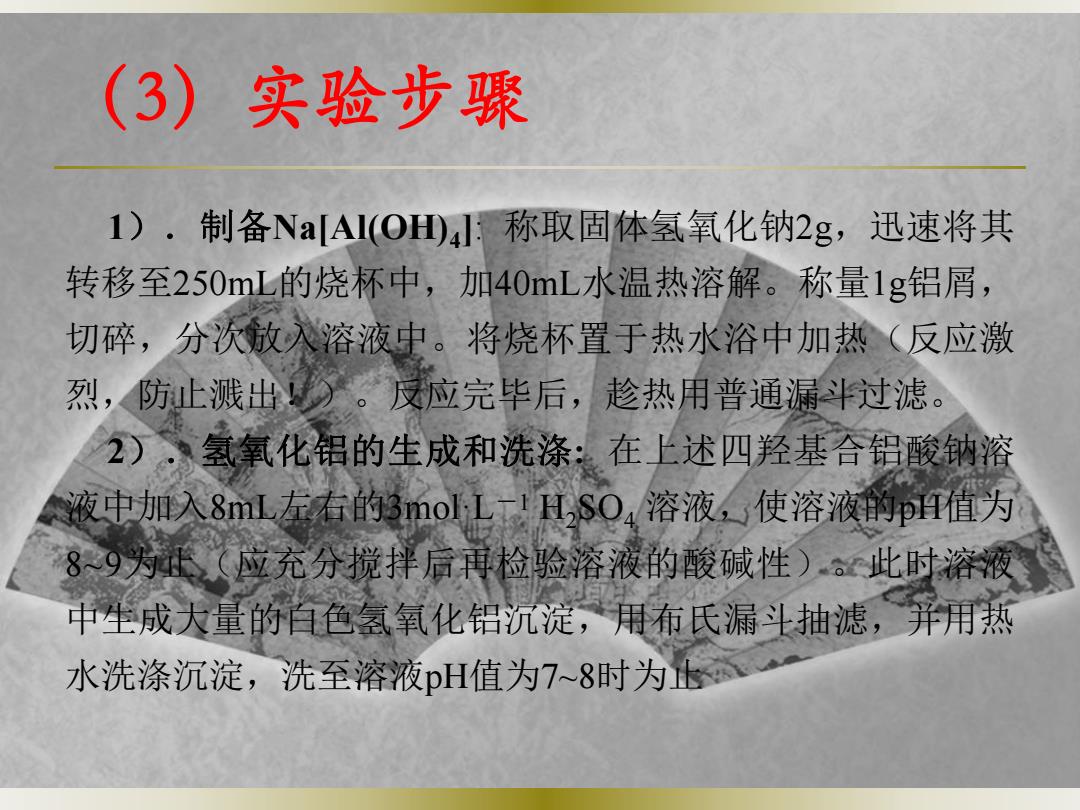
(3)实验步骤 1)·制备NaAI(OH田4称取固体氢氧化钠2g,迅速将其 转移至250mL的烧杯中,加40mL水温热溶解。称量1g铝屑, 切碎,分次放入溶液中。将烧杯置于热水浴中加热(反应激 烈,防止溅出)。反应完毕后,趁热用普通漏斗过滤。 2)、氢氧化铝的生成和洗涤:在上述四羟基合铝酸钠溶 液中加入8mL左右的3 mol LTH,SO4溶液,使溶液的p值为 89为(应充分搅拌后再检验溶液的酸碱性)此时溶液 中生成大量的百色氢氧化铝沉淀,用布氏漏斗抽滤,并用热 水洗涤沉淀,洗至溶液pH值为7~8时为
(3)实验步骤 1).制备Na[Al(OH) 4]: 称取固体氢氧化钠2g,迅速将其 转移至250mL的烧杯中,加40mL水温热溶解。称量1g铝屑, 切碎,分次放入溶液中。将烧杯置于热水浴中加热(反应激 烈,防止溅出!)。反应完毕后,趁热用普通漏斗过滤。 2).氢氧化铝的生成和洗涤: 在上述四羟基合铝酸钠溶 液中加入8mL左右的3mol·L-1 H2SO4 溶液,使溶液的pH值为 8~9为止(应充分搅拌后再检验溶液的酸碱性)。此时溶液 中生成大量的白色氢氧化铝沉淀,用布氏漏斗抽滤,并用热 水洗涤沉淀,洗至溶液pH值为7~8时为止