
,DcA土lD2+过些hn)空恤压h具ha边02- 由此可见,在重量分析法中利用同离子效应(即 加大沉淀剂的用量)可以大大降低沉淀的溶解度 ,这是保证沉淀趋于完全的重要措施之一。但并 非沉淀剂加入的量越多越好,因为沉淀加得太 多,有时可能引起盐效应、酸效应及络合效应等 副反应,反而使沉淀的溶解度增大 =[Ba 1.1×108molL-1 在200 的损失量为: 1.1×1 L-1×200mL×233.4g/mol=0.0005mg<<0,2mg 沉淀剂用量:一般可挥发性沉淀剂过量50%~100% 非挥发性沉淀剂过量20%~30%为宜
例: BaSO4法测Ba2+时,若加入等物质的量的沉淀剂SO4 2- , 则BaSO4的溶解度为: 若加入过量H2SO4,使沉淀后溶液中的[SO4 2-] =0.01 mol·L -1 , 则溶解度为: S=[Ba2+]=Ksp/[SO4 2- ]=1.1×10-8 mol·L-1 在200mL溶液中的损失量为: 1.1×10-8 mol·L-1×200mL×233.4g/mol=0.0005mg 1 10 mol / L 200mL 233.4g / mol 0.5mg 200mL BaSO S [Ba ] [SO ] K 1.1 10 1 10 mol / L 5 4 1 0 5 s p 2 4 2 = = = = = = − + − − − 在 溶液中 的损失量为: 由此可见,在重量分析法中利用同离子效应(即 加大沉淀剂的用量)可以大大降低沉淀的溶解度 ,这是保证沉淀趋于完全的重要措施之一。但并 非沉淀剂加入的量越多越好,因为沉淀剂加得太 多,有时可能引起盐效应、酸效应及络合效应等 副反应,反而使沉淀的溶解度增大 沉淀剂用量:一般可挥发性沉淀剂过量50%~100% 非挥发性沉淀剂过量20%~30%为宜 << 0.2mg >0.2mg
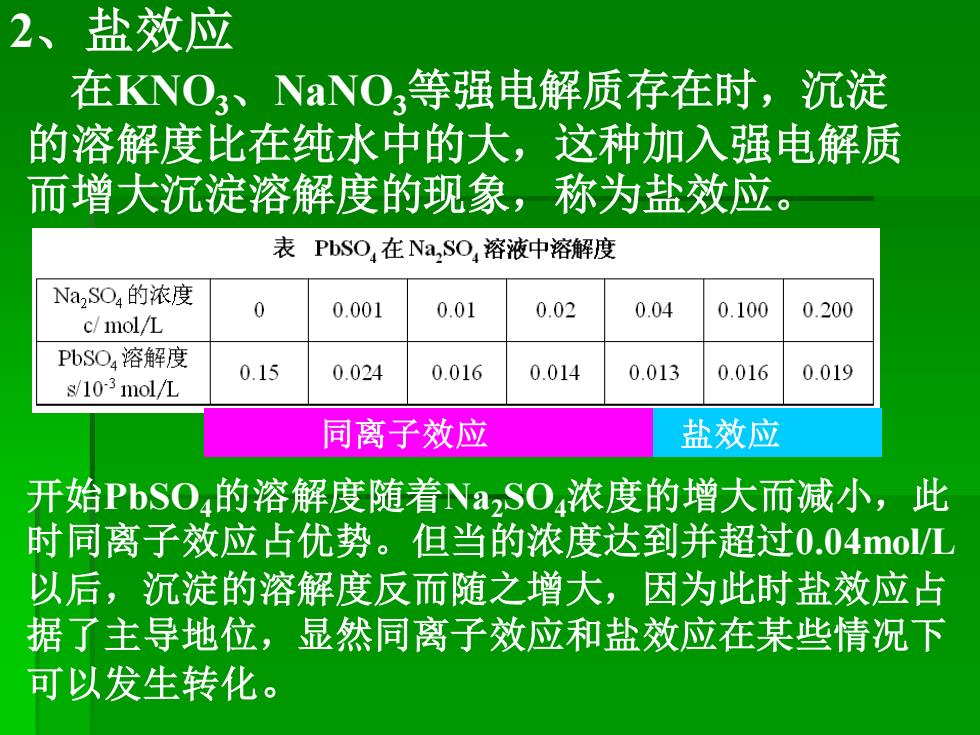
2、盐效应 在NO3、NaNO,等强电解质存在时,沉淀 的溶解度比在纯水中的大,这种加入强电解质 而增大沉淀溶解度的现象,称为盐效应 表PbSO,在Na,SO,溶液中溶解度 Na2SO4的浓度 0 0.001 0.01 0.02 0.04 0.100 0.200 c/mol/L PbSO4溶解度 0.15 0.024 0.016 0.014 0.013 0.016 0.019 s/10-31mol/九 同离子效应 盐效应 开始PbSO4的溶解度随着Na,SO,浓度的增大而减小,此 时同离子效应占优势。但当的浓度达到并超过0.04mo/L 以后,沉淀的溶解度反而随之增大,因为此时盐效应占 据了主导地位,显然同离子效应和盐效应在某些情况下 可以发生转化
2、盐效应 在KNO3、NaNO3等强电解质存在时,沉淀 的溶解度比在纯水中的大,这种加入强电解质 而增大沉淀溶解度的现象,称为盐效应。 开始PbSO4的溶解度随着Na2SO4浓度的增大而减小,此 时同离子效应占优势。但当的浓度达到并超过0.04mol/L 以后,沉淀的溶解度反而随之增大,因为此时盐效应占 据了主导地位,显然同离子效应和盐效应在某些情况下 可以发生转化。 同离子效应 盐效应
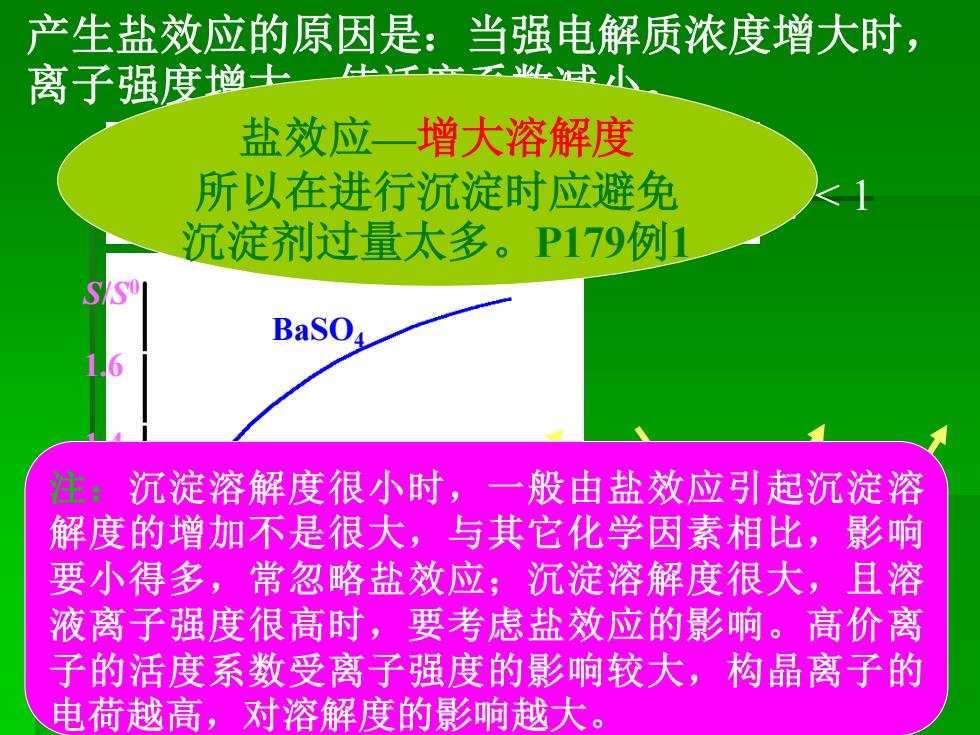
产生盐效应的原因是:当强电解质浓度增大时, 离子强度幽士 云以盐水 盐效应一增大溶解度 所以在进行沉淀时应避免 沉淀剂过量太多。P179例1 BaSO 注:沉淀溶解度很小时,一般由盐效应引起沉淀溶 解度的增加不是很大,与其它化学因素相比,影响 要小得多,常忽略盐效应;沉淀溶解度很大,且溶 液离子强度很高时,要考虑盐效应的影响。高价离 子的活度系数受离子强度的影响较大,构晶离子的 电荷越高,对溶解度的影响越大
S/S 0 1.6 1.4 1.2 1.0 0.001 0.005 0.01 c(KNO3 )/(mol·L-1 ) BaSO4 AgCl < 1 产生盐效应的原因是:当强电解质浓度增大时, 离子强度增大,使活度系数减小。 I i Ksp S 盐效应—增大溶解度 所以在进行沉淀时应避免 沉淀剂过量太多。P179例1 注:沉淀溶解度很小时,一般由盐效应引起沉淀溶 解度的增加不是很大,与其它化学因素相比,影响 要小得多,常忽略盐效应;沉淀溶解度很大,且溶 液离子强度很高时,要考虑盐效应的影响。高价离 子的活度系数受离子强度的影响较大,构晶离子的 电荷越高,对溶解度的影响越大
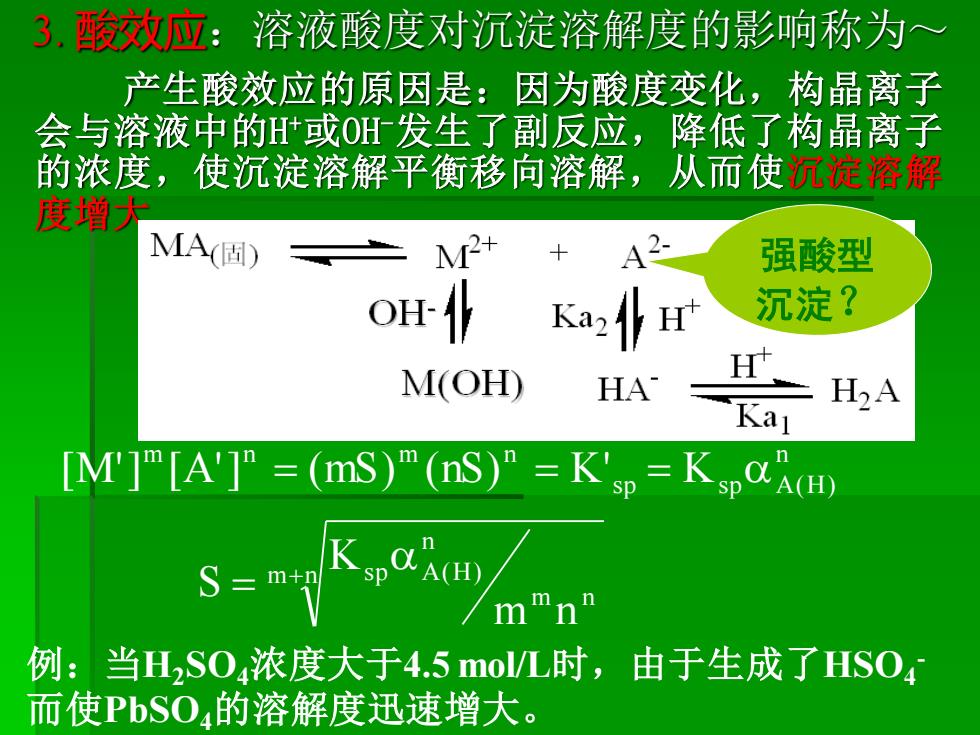
3.酸效应:溶液酸度对沉淀溶解度的影响称为~ 产生酸效应的原因是:因为酸度变化,构晶离子 会与溶液中的或OH发生了副反应,降低了构晶离子 的浓度,使沉淀溶解平衡移向溶解,从而使沉淀溶解 度增大 MA固) M2+ A2- 强酸型 沉淀? M(OH) HA H2A Kal [M]m[A']”=(nS)"(nS)”=K'sp=KspACH) S=m mmn 例:当HS04浓度大于4.5moL时,由于生成了HS04 而使PbSO4的溶解度迅速增大
3. 酸效应:溶液酸度对沉淀溶解度的影响称为~ 产生酸效应的原因是:因为酸度变化,构晶离子 会与溶液中的H +或OH-发生了副反应,降低了构晶离子 的浓度,使沉淀溶解平衡移向溶解,从而使沉淀溶解 度增大 例:当H2SO4浓度大于4.5 mol/L时,由于生成了HSO4 - 而使PbSO4的溶解度迅速增大。 m n m n n s p A(H) n s p s p A(H) m n m n m n K S [M'] [A'] (mS) (nS) K' K + = = = = 强酸型 沉淀?

(p181例2、例3、) 例如CaC2O4的溶解度 *pH=4.00时,6c204=0.39 1.0p H.C2O C.o 0.75 S=7.2×10-5mol/L *pH=2.00时,8c204=0.0054 0.50 0.25 S=6.1×10-4mo/L *pH=3.00时,6c204=0.058, pH Cc2o=0.010mo/L, 图2-2草酸三种形式的分布分数与pH的关系 Ksp=[Ca2+][C202-=SX 8 C204 XC C204 S=3.4×10-6mo/L(同离子效应+酸效应) 例4:自己看
(p181 例2、例3、) 例如 CaC2O4 的溶解度 * pH = 4.00时, δC2O4= 0.39 S = 7.2×10-5 mol/L *pH = 2.00时, δC2O4= 0.0054 S = 6.1×10-4 mol/L *pH = 3.00时,δC2O4= 0.058, C C2O4=0.010mol/L, Ksp = [Ca2+ ][C2O4 2- ]= S×δC2O4 ×C C2O4 S = 3.4×10-6 mol/L (同离子效应+酸效应) 例4:自己看