
13.2 溶剂萃取分离法 13.2.1萃取原理与基本概念 KDD、E、R 13.2.2萃取类型与萃取平衡 Kex K'ex pHi 13.2.3萃取应用
13.2.1 萃取原理与基本概念 KD、D、E、R 13.2.2 萃取类型与萃取平衡 Kex、K’ ex、pH1/2 13.2.3 萃取应用 13.2 溶剂萃取分离法

13.2.1萃取原理与基本概念 依据:“相似相溶”。物质在极性不同的溶剂 中溶解度不同 水:极性。离子型化合物(亲水性)易溶: 有机溶剂(丙酮,CHCL3,CCL4,苯): 有机化合物(疏水性)易溶 萃取:将亲水性物质转化成疏水性化合物, 而进入有机相. 反萃取:恢复亲水性,再回到水相
依据: “相似相溶” 。 物质在极性不同的溶剂 中溶解度不同. 水: 极性。离子型化合物(亲水性)易溶; 有机溶剂(丙酮, CHCl3 , CCl4,苯): 有机化合物(疏水性)易溶. 萃取: 将亲水性物质转化成疏水性化合物, 而进入有机相. 反萃取: 恢复亲水性,再回到水相. 13.2.1 萃取原理与基本概念

分配平衡 Ao Organic Phase 示意图 Aw Water Phase 1.分配系数 Kp- A]。 [A]w 在一定温度下,浓度不太大时,K为常数, 称分配定律 严格说: K= a(A)o 中性分子 a(A)w Y≈1
分配平衡 示意图 1. 分配系数 D w o [A] [A] K = 在一定温度下,浓度不太大时,KD为常数, 称分配定律. 严格说: D w o (A) (A) a a K = 中性分子 ≈1 A Organic Phase o A Water Phase w
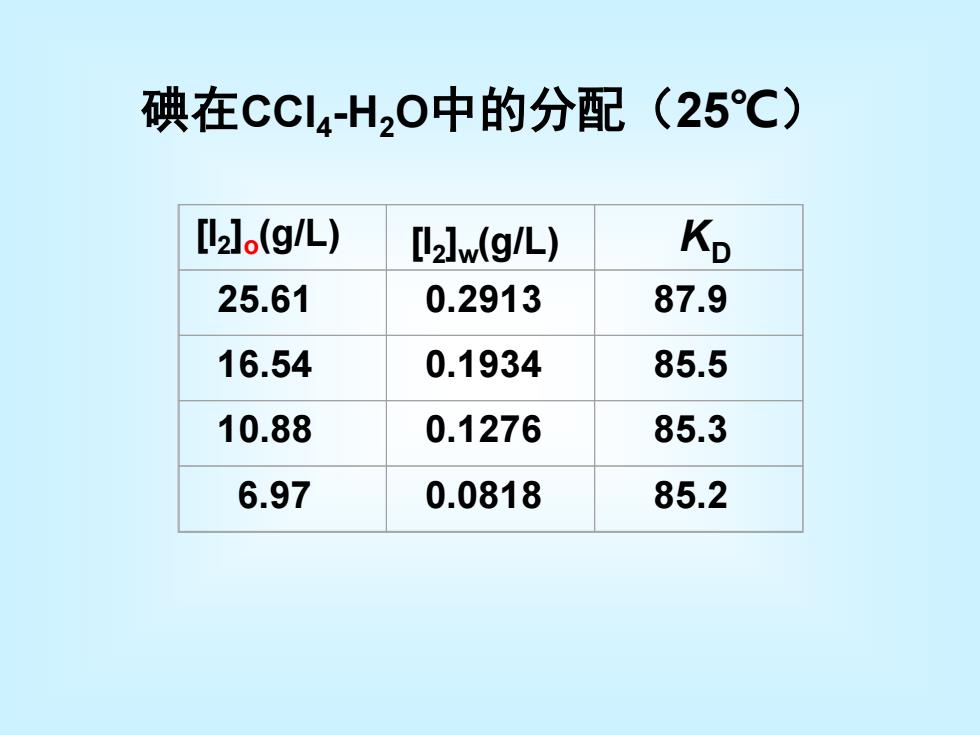
碘在CCl4H20中的分配(25C) [l2].(g/L) [I2]w(g/L) Kp 25.61 0.2913 87.9 16.54 0.1934 85.5 10.88 0.1276 85.3 6.97 0.0818 85.2
[I2 ]o (g/L) 25.61 0.2913 87.9 16.54 0.1934 85.5 10.88 0.1276 85.3 6.97 0.0818 85.2 [I2 ]w(g/L) KD 碘在CCl4 -H2O中的分配(25℃)

2.分配比 D C(A)。_[A。+[Azl。+- C(A)w [A Jw +[A2Jw +- 例:有「存在时,2在CCL4一H20中的分配 D= [l2]o [2l。 Ko [l2]w +[ls]w [l2]w(1+I]B) 02) D与K之关系 2+=5,B=710) IgD IgKp 当[]B>1,( )>1,则D<K。 当[]B<1,a,≈1,则D≈K +g[l门
2. 分配比 1 2 w 1 w 2 w o o o (A) [A ] +[A ] +- - - = = (A) [A ] +[A ] +- - - c D c 2 2 o 2 o 2 w 3 w 2 w D I (I ) [I ] [I ] [I ] [I ] [I ] (1 [I ] = ) K D − − − = = + +2 3 (I I I , 710) − − + = = lgKD lgD lg[I- ] - 2 - 2 - I (I ) D - I (I ) D [I ] 1, 1, [I ] 1, 1, D K D K 当 则 当 则 例:有I -存在时, I2在CCl4-H2O中的分配 D与KD之关系