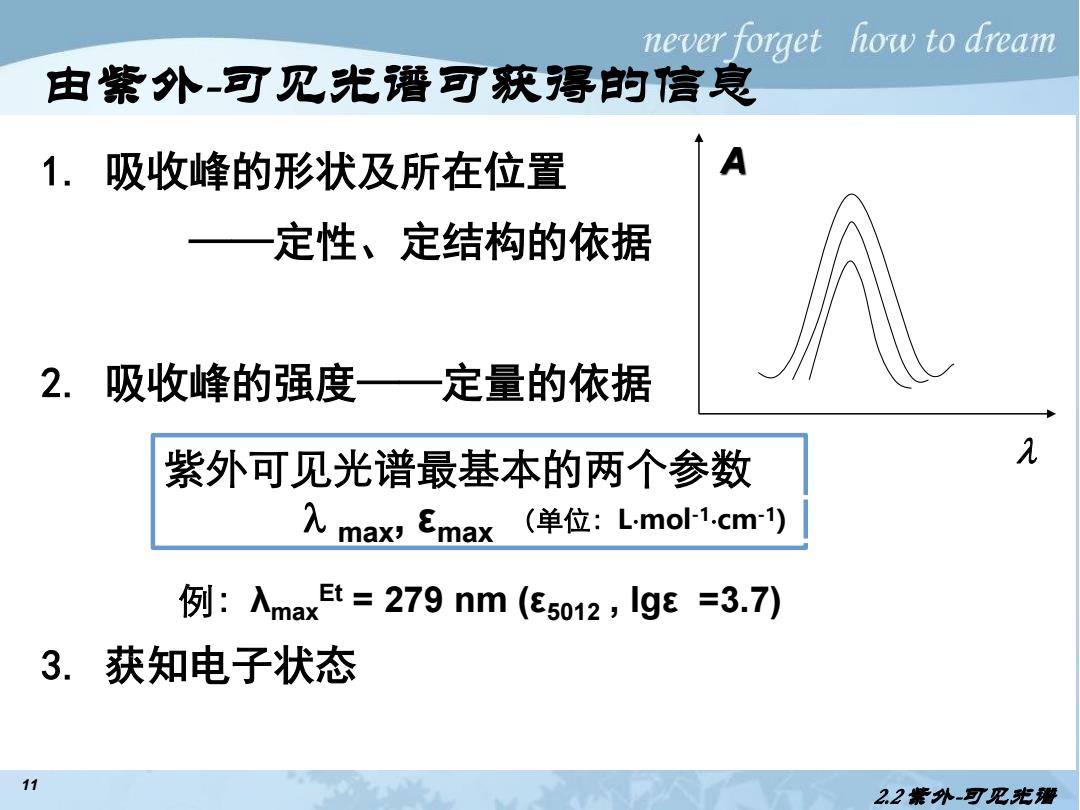
never forget how to dream 由紫外-可见光谱可获得的信良 1,吸收峰的形状及所在位置 A 定性、定结构的依据 2.吸收峰的强度—定量的依据 紫外可见光谱最基本的两个参数 λ 入max,Emax (单位:Lmo1.cm1) 例:入maxt=279nm(e5012,lgE=3.7) 3.获知电子状态 11 22紫外-可见光潜
11 由紫外-可见光谱可获得的信息 1. 吸收峰的形状及所在位置 ——定性、定结构的依据 2. 吸收峰的强度——定量的依据 3. 获知电子状态 A 2.2 紫外-可见光谱 紫外可见光谱最基本的两个参数 max, εmax 例:λmax Et = 279 nm (ε5012 , lgε =3.7) (单位:Lmol-1cm-1)

223紫外-可见光疆的特亚 never forget how to aream 在紫外-可见光谱中: E>104 强吸收 £=103~104 较强吸收 E=102-103 中吸收 E<102 弱吸收 12 22紫外-可见光覆
12 2.2 紫外-可见光谱 2.2.3 紫外-可见光谱的特征 ε > 104 强吸收 ε = 103~104 较强吸收 ε = 102~103 中吸收 ε < 102 弱吸收 在紫外-可见光谱中:

never forget how to dream 3.4紫外-可见光谱基本原理 物质的紫外-可见吸收光谱,决定于分子中的价电子 的跃迁 按分子轨道理论,在分子中有几种不同性质的价电子: σ电子:形成单键的电子 π电子:形成双键的电子 n电子:未成键的孤对电子,又称非键电子,或p电子 如氧,氮,硫,卤素等 13 22紫外-可见光遭
13 物质的紫外-可见吸收光谱,决定于分子中的价电子 的跃迁 按分子轨道理论,在分子中有几种不同性质的价电子: σ电子:形成单键的电子 π电子:形成双键的电子 n电子:未成键的孤对电子,又称非键电子,或p电子 如氧,氮,硫,卤素等 3.4 紫外-可见光谱基本原理 2.2 紫外-可见光谱
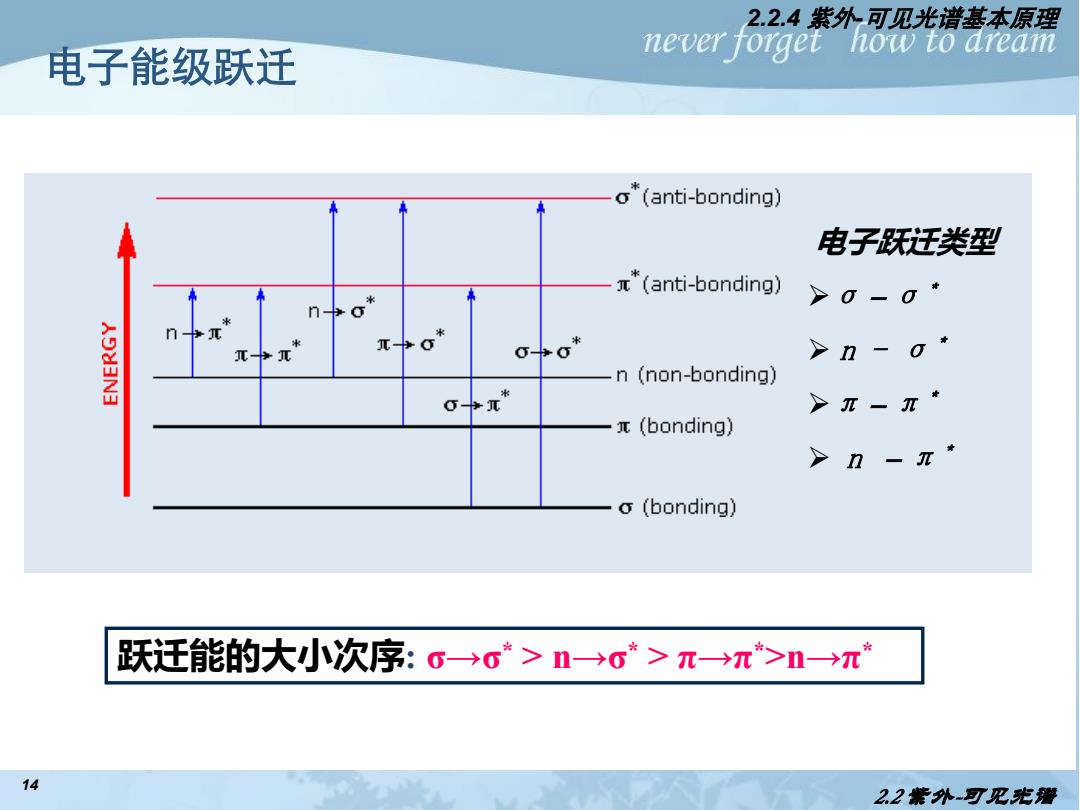
2.2.4紫外可见光谱基本原理 电子能级跃迁 never forget how to dream o*(anti-bonding) 电子跃迁类型 π*(anti-bonding) >0-01 >n-01 n (non-bonding) 0π* >π-π1 π(bonding) > o(bonding) 跃迁能的大小次序:。→c*>n→c*>π→π*>n→π* 14 22紫外-可见光遭
14 电子能级跃迁 电子能级 跃迁示意图 跃迁能的大小次序: σ→σ * > n→σ * > π→π *>n→π * 电子跃迁类型 ➢σ-σ* ➢ n - σ* ➢π-π* ➢ n -π* 2.2.4 紫外-可见光谱基本原理 2.2 紫外-可见光谱
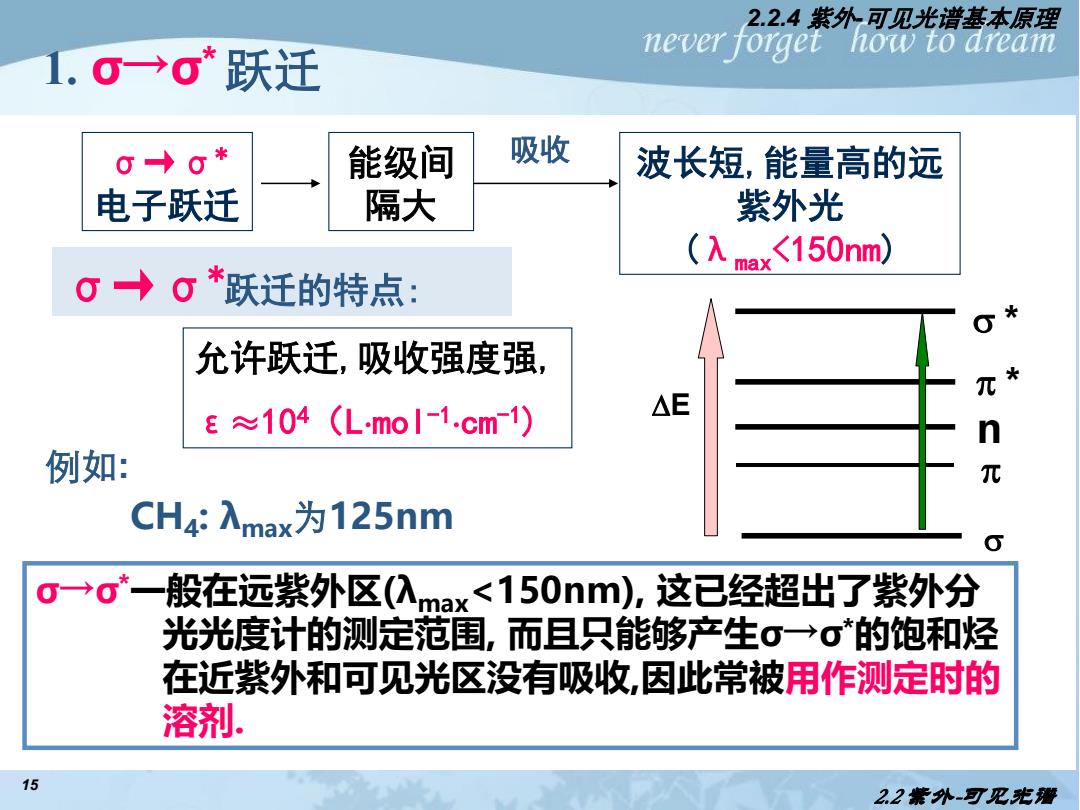
2.2.4紫外-可见光谱基本原理 1.0→σ*跃迁 never forget how to dream 0→0* 能级间 吸收 波长短,能量高的远 电子跃迁 隔大 紫外光 (入 ax<150nm) g→g *跃迁的特点: 允许跃迁,吸收强度强 E≈104(LmoI-1.cm1) △E n 例如: 元 CH4:入max为125nm o一o一般在远紫外区(max<150nm),这已经超出了紫外分 光光度计的测定范围,而且只能够产生σ→σ的饱和烃 在近紫外和可见光区没有吸收,因此常被用作测定时的 溶剂. 15 22紫外-可见光覆
15 1. σ→σ*跃迁 σ→σ* 电子跃迁 能级间 隔大 波长短,能量高的远 紫外光 (λmax<150nm) 吸收 例如: CH4 : λmax为125nm σ→σ*一般在远紫外区(λmax<150nm), 这已经超出了紫外分 光光度计的测定范围, 而且只能够产生σ→σ*的饱和烃 在近紫外和可见光区没有吸收,因此常被用作测定时的 溶剂. σ→σ*跃迁的特点: 允许跃迁,吸收强度强, ε≈104(Lmol-1 cm-1) s p * s * n p E 2.2 紫外-可见光谱 2.2.4 紫外-可见光谱基本原理