
无机化学实验指导 一、明确实验的意义和目的 化学是一门中心科学。这是因为一方面化学学科本身迅猛发展,另一方面化学在发展过 程中为相关学科的发展提供了物质基础,因此,化学无论是作为基础知识,还是作为其他学 科的基础,或是研究问题的方法,以及解决各类难题的特殊手段,都是其他任何学科无法代 替的,可以说化学当今正处在一个多边关系的中心,并且渗透到现代社会几乎所有的领域。 化学是 门实验科学。许多化学理论和规 都源自 实验,同时,这些理论和规律的应用 也要通过实验来检验。因此,化学实验教学在培养未来化学工作者的大学教有中占有相当重 要的地位。 无机及分析化学实验是化学及相关专业大学生的第一门实验必修课,是学好其他化学课 程的前提和基础。本实验课程包括无机化学实验与分析化学实验两门实验课的有关内容,一 者紧密结合,融会贯通,形成一门独立的课程,但又与相应的理论课有紧密的联系 通过实验,学生可以直接获得大量的物质变化的感性认识,经过思考、归纳和总结,从 感性认识上升到理性认识,从而加深对无机及分析化学基本知识和基本理论的理解和掌握, 并运用它们指导实验。 通过实验,学生可以熟零元素及其化合物的重要性质和反应:掌提重要无机化合物的 般制备、分离和提纯方法及分析鉴定方法:了解确定物质组成、含量和结构的各种分析方法 正确和熟练掌握常用仪器的使用、基本操作和技能掌握常见工作基准试剂 ,和指示剂的 用:掌握常用的滴定方法,确立严格的“量”的概念,并学会运用误差理论正确处理实验数 据。 通过综合实验,学生可以全面系统地学习化学实验的全过程,综合培养学生动手、观测 查阅、记忆、更维、相像及表达等全部智力因素,从而使学生具各分析问颗、解决问颗的独 立工作能力:通过设计实验,学生由提出问题 、查阅资料、设计方案、动手实验、 观察现等 测定数据,然后加以正确处理和总结,并把实验结果正确表达出来,练习解决化学问题,以 使学生初步具备从事科学研究的能力。 在培养智力因素的同时,化学实验又是对学生进行非智力因素训练的理想场所,包括艰 苦创业、勤奋好学、团结协作、求实创新、求真存疑等科学品德和科学精神的训练,而整洁、 节约、准确、有条不素等良好的实验习惯的养成,同样是每一个化学工作者获得成功所不可 缺少的因素 总之,通过实验,学生能够养成严谨的实事求是的科学态度,树立勇于开拓的创新意识, 提高综合素质,为学习后续化学课程,参加实际工作和开展科学研究打下坚实的基础。 二、掌握正确的学习方法 要做好无机及分析化学实验,不仅要有正确的学习态度,而且还需要有正确的学习方法, 无机及分析化学实险学习方法可归钠成以下几方面: 1.充分预习 实验前预习是必要的准备工作,是做好实验的前提和保证。预习应达到下列要求: (1)认真阅读实验教材及有关参考资料,明确实验目的、理解实验原理,熟悉实验内 容、掌握实验方法 “解基本操作和仪器的使用方法及注意事项。 (2)根据实验内容查阅附录及有关手册,列出实验所需的物理化学数据,在此基础上, 写出预习报告
无机化学实验指导 一、明确实验的意义和目的 化学是一门中心科学。这是因为一方面化学学科本身迅猛发展,另一方面化学在发展过 程中为相关学科的发展提供了物质基础,因此,化学无论是作为基础知识,还是作为其他学 科的基础,或是研究问题的方法,以及解决各类难题的特殊手段,都是其他任何学科无法代 替的,可以说化学当今正处在一个多边关系的中心,并且渗透到现代社会几乎所有的领域。 化学是一门实验科学。许多化学理论和规律都源自实验,同时,这些理论和规律的应用 也要通过实验来检验。因此,化学实验教学在培养未来化学工作者的大学教育中占有相当重 要的地位。 无机及分析化学实验是化学及相关专业大学生的第一门实验必修课,是学好其他化学课 程的前提和基础。本实验课程包括无机化学实验与分析化学实验两门实验课的有关内容,二 者紧密结合,融会贯通,形成一门独立的课程,但又与相应的理论课有紧密的联系。 通过实验,学生可以直接获得大量的物质变化的感性认识,经过思考、归纳和总结,从 感性认识上升到理性认识,从而加深对无机及分析化学基本知识和基本理论的理解和掌握, 并运用它们指导实验。 通过实验,学生可以熟悉元素及其化合物的重要性质和反应;掌握重要无机化合物的一 般制备、分离和提纯方法及分析鉴定方法;了解确定物质组成、含量和结构的各种分析方法; 正确和熟练掌握常用仪器的使用、基本操作和技能;掌握常见工作基准试剂、和指示剂的使 用;掌握常用的滴定方法,确立严格的“量”的概念,并学会运用误差理论正确处理实验数 据。 通过综合实验,学生可以全面系统地学习化学实验的全过程,综合培养学生动手、观测、 查阅、记忆、思维、想像及表达等全部智力因素,从而使学生具备分析问题、解决问题的独 立工作能力;通过设计实验,学生由提出问题、查阅资料、设计方案、动手实验、观察现象、 测定数据,然后加以正确处理和总结,并把实验结果正确表达出来,练习解决化学问题,以 使学生初步具备从事科学研究的能力。 在培养智力因素的同时,化学实验又是对学生进行非智力因素训练的理想场所,包括艰 苦创业、勤奋好学、团结协作、求实创新、求真存疑等科学品德和科学精神的训练,而整洁、 节约、准确、有条不紊等良好的实验习惯的养成,同样是每一个化学工作者获得成功所不可 缺少的因素。 总之,通过实验,学生能够养成严谨的实事求是的科学态度,树立勇于开拓的创新意识, 提高综合素质,为学习后续化学课程,参加实际工作和开展科学研究打下坚实的基础。 二、掌握正确的学习方法 要做好无机及分析化学实验,不仅要有正确的学习态度,而且还需要有正确的学习方法。 无机及分析化学实验学习方法可归纳成以下几方面: 1.充分预习 实验前预习是必要的准备工作,是做好实验的前提和保证。预习应达到下列要求: (1)认真阅读实验教材及有关参考资料,明确实验目的、理解实验原理,熟悉实验内 容、掌握实验方法,了解基本操作和仪器的使用方法及注意事项。 (2)根据实验内容查阅附录及有关手册,列出实验所需的物理化学数据,在此基础上, 写出预习报告

(3)实验前教师要检查学生的预习情况,若发现学生预习不够充分,应令其停止实验 重新预习,达到预习要求后方可进行实验 2.认真实验 (1)根据实验教材上所规定的方法、步骤和试剂用量规范操作,既要大胆又要细心, 仔细观察实验现象,认真详实地做好实验记录。 (2)实验中观察到的现象、测定的数据要如实记录在报告本上,不得用铅笔随意记在 草纸或实验教材上:不凭主观意愿去自己认为不对的数据:更不能杜撰原始数据:原始数 据不得随意涂改,如果订 在原来数据 划一道杠,再在上面或旁边写 :正确数 (3)在实验中遇到疑难问题或者“反常现象”,应首先尊重实验事实,并认真分析和 检查其原因,做对照、空白试验,或自行设计实验进行核对,必要时应多次重复验证,直到 从中得到正确结论。 (4)实哈过程中要勒于思考,遇到问题要善于仔细分析,力争独立解决问题:遇到厨 难问题而自己无法解决时,可请教指导教师给予指导。如实验失败,要查明原因,经教师准 许后重作实验 (5)在实验过程中应该保持肃静,严格遵守实验守则。自觉养成良好的实验习惯,始 终保持实验桌面布局合理、环境整洁。实验结束后,必须经指导教师在原始记录本上签字后 才能离开实验室。 3。作好总 做完实验仅 是完成实验的一部分,余下更为重要的任务是分析实验现象、整理实验数据, 对实验进行全面总结,写出实验报告。 (1)根据所做的实验记录,对实验现象进行解释,写出反应式,处理原始数据,并进 行归纳总结得出结论。 (2)对实验结果进行讨论,分析误差产生的原因,回答相关的思考题,对实验内容和 实验方法提出改进意见或建议 4.实验报告 实验报告要求按一定格式书写,字迹端正,叙述简明扼要,实验记录和数据处理使用表 格形式,作图准确清楚,报告本整齐清洁。 实验报告的书写一般分三部分,即 (1)预习部分(实验前完成)》 按实验目的、原理(扼要)、步骤(简明)几项书写。 (2)记录部分(实验时完成) 括实验现象、测定数据 这部分称为原始数据。 (3)结论部分(实验后完成) 包括对实验现象的分析、解释和结论,原始数据的处 理、误差分析和结果讨论。 5.实验报告格式 无机及分析化学实验大致可分为以下几种类型:制备实验、测定实验、性质实验、定量 分析实验、定性分析实验。现将几种不同类型的实验报告格式介绍如下,以供参考
(3)实验前教师要检查学生的预习情况,若发现学生预习不够充分,应令其停止实验, 重新预习,达到预习要求后方可进行实验。 2.认真实验 (1)根据实验教材上所规定的方法、步骤和试剂用量规范操作,既要大胆又要细心, 仔细观察实验现象,认真详实地做好实验记录。 (2)实验中观察到的现象、测定的数据要如实记录在报告本上,不得用铅笔随意记在 草纸或实验教材上;不凭主观意愿删去自己认为不对的数据;更不能杜撰原始数据;原始数 据不得随意涂改,如果记录错误,可在原来数据上划一道杠,再在上面或旁边写上正确数据。 (3)在实验中遇到疑难问题或者“反常现象”,应首先尊重实验事实,并认真分析和 检查其原因,做对照、空白试验,或自行设计实验进行核对,必要时应多次重复验证,直到 从中得到正确结论。 (4)实验过程中要勤于思考,遇到问题要善于仔细分析,力争独立解决问题;遇到疑 难问题而自己无法解决时,可请教指导教师给予指导。如实验失败,要查明原因,经教师准 许后重作实验。 (5)在实验过程中应该保持肃静,严格遵守实验守则。自觉养成良好的实验习惯,始 终保持实验桌面布局合理、环境整洁。实验结束后,必须经指导教师在原始记录本上签字后 才能离开实验室。 3.作好总结 做完实验仅是完成实验的一部分,余下更为重要的任务是分析实验现象、整理实验数据、 对实验进行全面总结,写出实验报告。 (1)根据所做的实验记录,对实验现象进行解释,写出反应式,处理原始数据,并进 行归纳总结得出结论。 (2)对实验结果进行讨论,分析误差产生的原因,回答相关的思考题,对实验内容和 实验方法提出改进意见或建议。 4.实验报告 实验报告要求按一定格式书写,字迹端正,叙述简明扼要,实验记录和数据处理使用表 格形式,作图准确清楚,报告本整齐清洁。 实验报告的书写一般分三部分,即: (1)预习部分(实验前完成) 按实验目的、原理(扼要)、步骤(简明)几项书写。 (2)记录部分(实验时完成) 包括实验现象、测定数据,这部分称为原始数据。 (3)结论部分(实验后完成) 包括对实验现象的分析、解释和结论,原始数据的处 理、误差分析和结果讨论。 5. 实验报告格式 无机及分析化学实验大致可分为以下几种类型:制备实验、测定实验、性质实验、定量 分析实验、定性分析实验。现将几种不同类型的实验报告格式介绍如下,以供参考
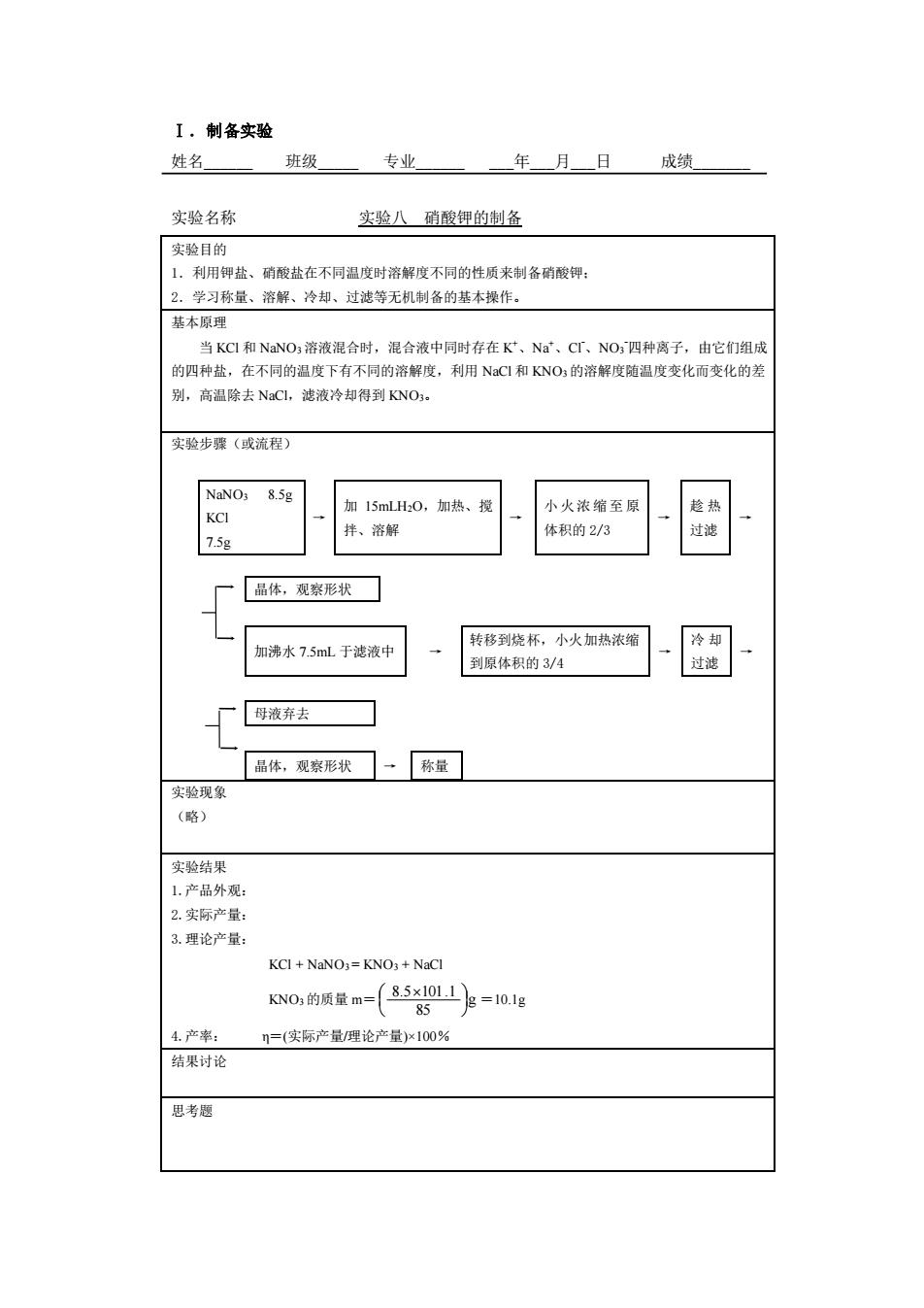
,制备实验 姓名 班级 专业 年月日成绩 实验名称 实验八硝酸钾的制各 实验目的 利用钾盐、硝酸盐在不同温度时溶解度不同的性质来制备硝酸钾: 2 习称量、溶解、冷却、过滤等无机制备的基本操作。 基本原理 当KC和NaNO溶液混合时,混合液中同时存在K、Na、CT、NO四种离子,由它们组成 的四种盐。在不同的温度下有不同的溶解度,利用NaC和KNO:的溶解度随温度变化而变化的差 别,高温除去NaC,滤液冷却得到KNO。 实验步骤(或流程) 网 加15mlLH0,加热、搅 小火浓缩至原 7.5g 拌、溶解 体积的23 一品体,观察形状☐ 加沸水75ml于滤液中 转移到烧杯,小火加热浓缩 到原体积的3/4 品体,观察形状☐一称量门 实验现象 (略) 实验结果 1.产品外观: 2.实际产量: 3.理论产量: KCI+NaNO3=KNO3+NaCl 0的量a-(5器多-0g 4产率: n=(实际产量/理论产量)x100% 结果讨论 思考腿
Ⅰ.制备实验 姓名_ 班级_ 专业_ _年_月_日 成绩_ 实验名称 实验八 硝酸钾的制备 实验目的 1.利用钾盐、硝酸盐在不同温度时溶解度不同的性质来制备硝酸钾; 2.学习称量、溶解、冷却、过滤等无机制备的基本操作。 基本原理 当 KCl 和 NaNO3溶液混合时,混合液中同时存在 K +、Na+、Cl-、NO3 -四种离子,由它们组成 的四种盐,在不同的温度下有不同的溶解度,利用 NaCl 和 KNO3的溶解度随温度变化而变化的差 别,高温除去 NaCl,滤液冷却得到 KNO3。 实验步骤(或流程) NaNO3 8.5g KCl 7.5g → 加 15mLH2O,加热、搅 拌、溶解 → 小火浓缩至原 体积的 2/3 → 趁 热 过滤 → 晶体,观察形状 加沸水 7.5mL 于滤液中 → 转移到烧杯,小火加热浓缩 到原体积的 3/4 → 冷 却 过滤 → 母液弃去 晶体,观察形状 → 称量 实验现象 (略) 实验结果 1.产品外观: 2.实际产量: 3.理论产量: KCl + NaNO3 = KNO3 + NaCl KNO3的质量 m= g 85 8.5 101.1 =10.1g 4.产率: η=(实际产量/理论产量)×100% 结果讨论 思考题
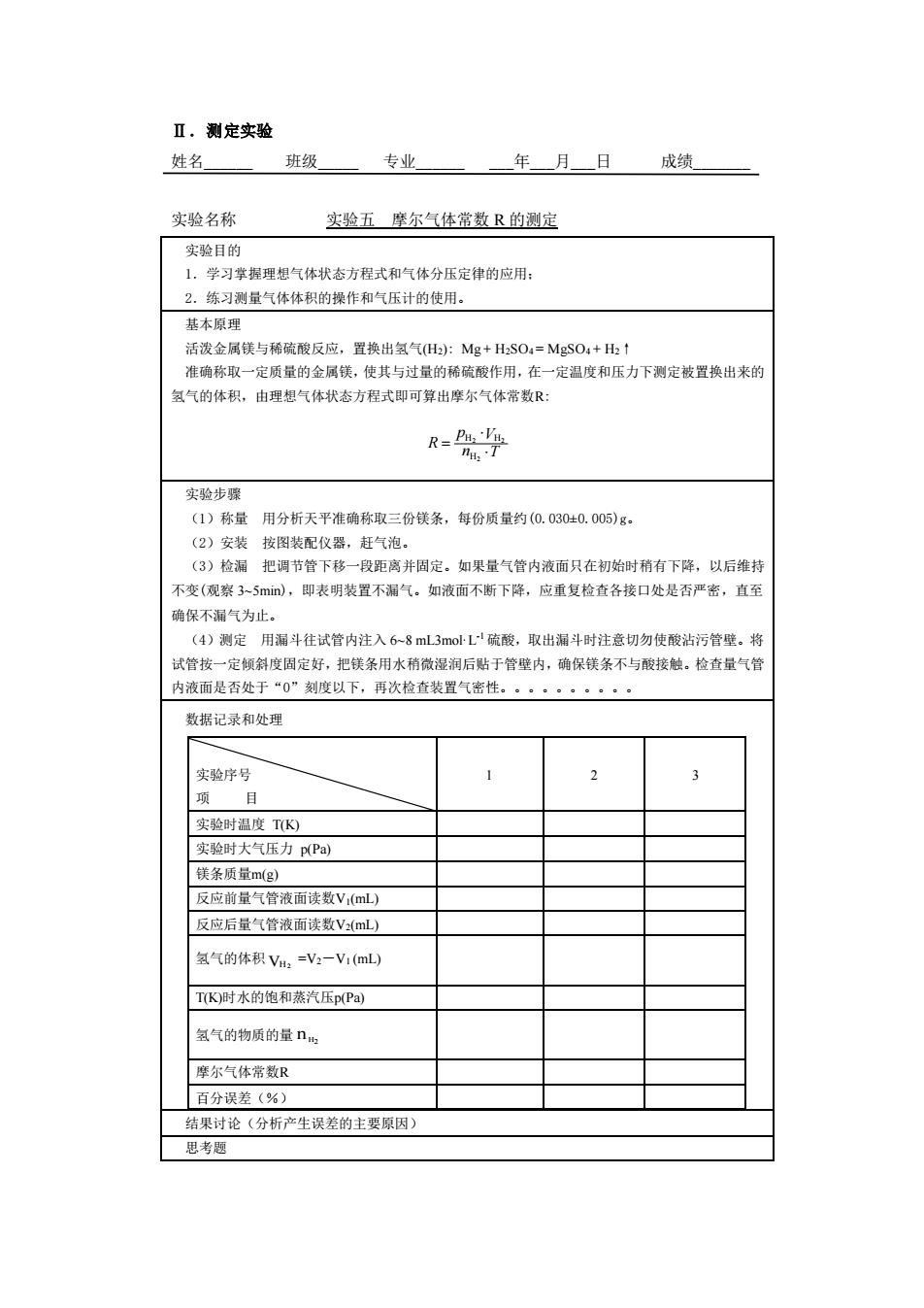
Ⅱ.测定实验 姓名 班级 专业 年月日成绩 实验名称 实验五摩尔气体常数R的测定 实验目的 学习掌握理想气体状态方程式和气体分压定律的应用 2。练习测量气体体积的操作和气压计的使用。 基本原理 活泼金属挂与稀随酸反应,置挽出复气H:Mg+日,SO1=MSOA+H,: 准确称取一定质量的金属镁,使其与过量的稀 酸作用,在一定温度和压力下测定被置换出来的 氢气的体积,由理想气体状态方程式即可算出摩尔气体常数R 实验步 (1)称量 用分析天平准确称取三份钱条,每份质量约(Q.03040.005)g, (2)安装按图装配仪器,赶气泡。 (3)检漏把调节管下移一段距离并固定。如果量气管内液而只在初始时稍有下降,以后维持 不变(观察3Smi),即表明装置不漏气。如液面不断下降,应重复检查各接口处是否严密,直至 确保不漏气为止。 (4)测定用漏斗往试管内注入68ml3m0上硫酸,取出漏斗时注意切勿使酸沾污管壁。将 试管按一定倾斜度固定好,把铁条用水稍微湿润后贴于管壁内,确保钱条不与酸接触。检查量气管 内液面是否处于“0”刻度以下,再次检查装置气密性。·。 数据记录和处理 实验序号 1 2 项目 空珍时温度TK 实验时大气压力pPa) 镁条质量m(g) 反应前量气管液面读数V(mL) 反应后量气管液面读数VmL) 氢气的体积V=V-V1mL TK时水的饱和蒸汽压p(P) 氢气的物质的量ng 摩尔气体常数R 百分误差《%) 结果讨论《分析产生误差的主要原因) 思考
Ⅱ.测定实验 姓名_ 班级_ 专业_ _年_月_日 成绩_ 实验名称 实验五 摩尔气体常数 R 的测定 实验目的 1.学习掌握理想气体状态方程式和气体分压定律的应用; 2.练习测量气体体积的操作和气压计的使用。 基本原理 活泼金属镁与稀硫酸反应,置换出氢气(H2): Mg + H2SO4 = MgSO4 + H2↑ 准确称取一定质量的金属镁,使其与过量的稀硫酸作用,在一定温度和压力下测定被置换出来的 氢气的体积,由理想气体状态方程式即可算出摩尔气体常数R: n T p V R = 2 2 2 H H H 实验步骤 (1)称量 用分析天平准确称取三份镁条,每份质量约(0.030±0.005)g。 (2)安装 按图装配仪器,赶气泡。 (3)检漏 把调节管下移一段距离并固定。如果量气管内液面只在初始时稍有下降,以后维持 不变(观察 3~5min),即表明装置不漏气。如液面不断下降,应重复检查各接口处是否严密,直至 确保不漏气为止。 (4)测定 用漏斗往试管内注入 6~8 mL3mol·L -1硫酸,取出漏斗时注意切勿使酸沾污管壁。将 试管按一定倾斜度固定好,把镁条用水稍微湿润后贴于管壁内,确保镁条不与酸接触。检查量气管 内液面是否处于“0”刻度以下,再次检查装置气密性。 数据记录和处理 实验序号 项 目 1 2 3 实验时温度 T(K) 实验时大气压力 p(Pa) 镁条质量m(g) 反应前量气管液面读数V1(mL) 反应后量气管液面读数V2(mL) 氢气的体积 VH2 =V2-V1 (mL) T(K)时水的饱和蒸汽压p(Pa) 氢气的物质的量 n H2 摩尔气体常数R 百分误差(%) 结果讨论(分析产生误差的主要原因) 思考题
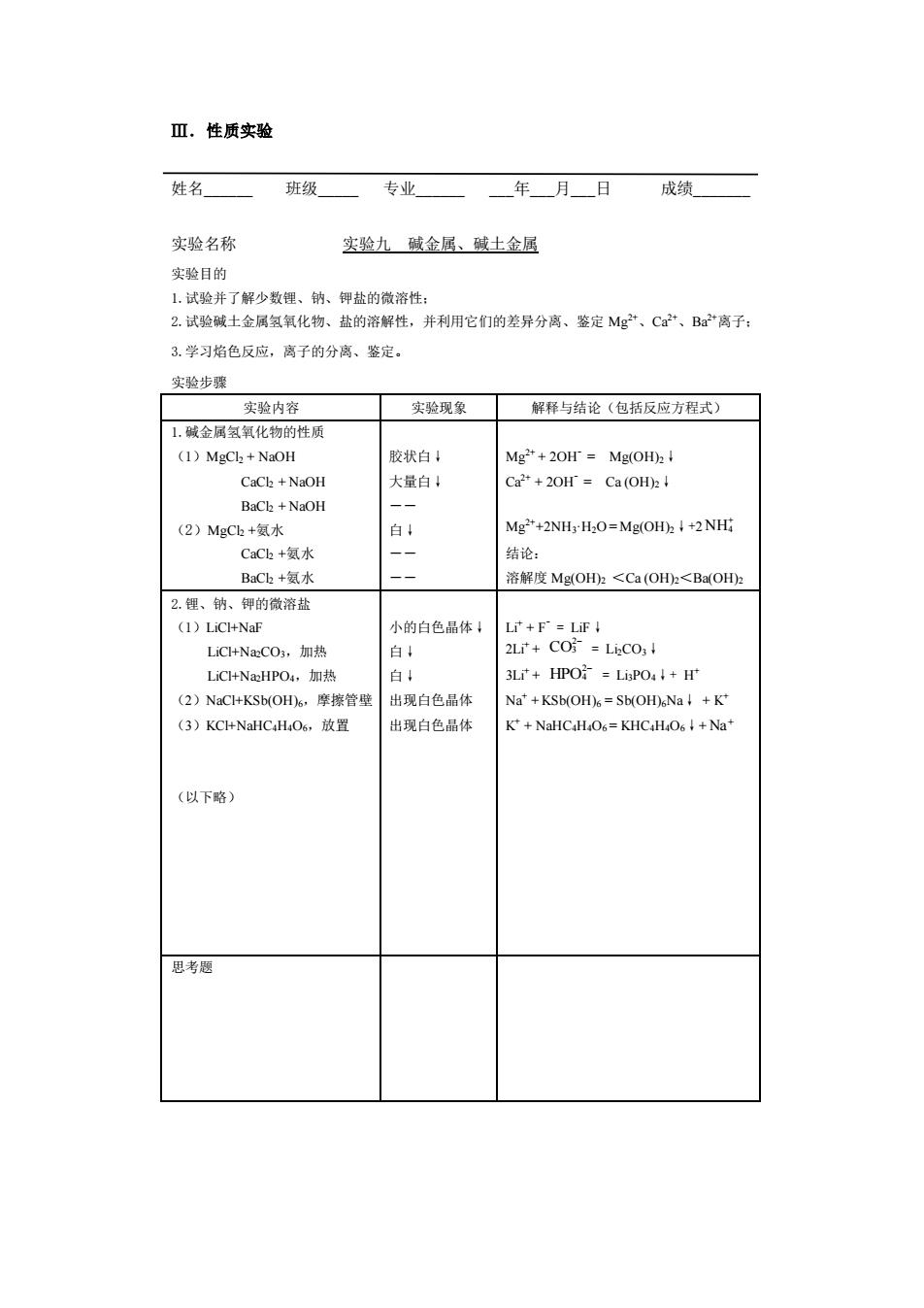
Ⅲ.性质实验 姓名 班级 专业 年月日成绩 实验名称 实验九破金居、破土金屈 实验目的 1.试验并了解少数锂、钠、钾盐的微溶性: 2.试验碱土金属氢氧化物、盐的溶解性,并利用它们的差异分离、鉴定Mg”、C”、B”离子: 3.学习焰色反应,离子的分离、整定 实验步骤 实验内容 实验现象 解释与结论(包括反应方程式) 1.碱金属氢氧化物的性质 (1)MgCl+NaOH 胶状白! Mg"+20H=Mg(OH):! CaCh +NaOH 大量白 C2+20Hr=Ca(oHh↓ BaCk +NaOH (2)MgCb+氨水 Mg*+2NH:H:O=Mg(OH)I+2NHi CCk+氨水 一 结论 BaC+氨水 溶解度MgOH2<Ca(OH2<Ba(OHz 2.锂、钠、每的微济盐 小的白色品体 L+F=LFI LC+NaCO,加热 2L+co防=Lic01 LiC+Na:HPO4,加热 白4 3Lr+HPO=LiPO4+r (2)NaC+KSb(OH6,摩擦管壁 出现自色品体 Na'+KSb(OH%=Sb(OH%Na+K* (3)KC+NaHC.H.O6,.放置 出现白色品体 K+NaHC H06=KHCH O64+Nat (以下略) 思考题
Ⅲ.性质实验 姓名_ 班级_ 专业_ _年_月_日 成绩_ 实验名称 实验九 碱金属、碱土金属 实验目的 1.试验并了解少数锂、钠、钾盐的微溶性; 2.试验碱土金属氢氧化物、盐的溶解性,并利用它们的差异分离、鉴定 Mg2+、Ca2+、Ba2+离子; 3.学习焰色反应,离子的分离、鉴定。 实验步骤 实验内容 实验现象 解释与结论(包括反应方程式) 1.碱金属氢氧化物的性质 (1)MgCl2 + NaOH CaCl2 + NaOH BaCl2 + NaOH (2)MgCl2 +氨水 CaCl2 +氨水 BaCl2 +氨水 胶状白↓ 大量白↓ ―― 白↓ ―― ―― Mg2+ + 2OH- = Mg(OH)2↓ Ca2+ + 2OH- = Ca (OH)2↓ Mg2++2NH3·H2O = Mg(OH)2↓+2 NH4 + 结论: 溶解度 Mg(OH)2 <Ca (OH)2<Ba(OH)2 2.锂、钠、钾的微溶盐 (1)LiCl+NaF LiCl+Na2CO3,加热 LiCl+Na2HPO4,加热 (2)NaCl+KSb(OH)6,摩擦管壁 (3)KCl+NaHC4H4O6,放置 (以下略) 小的白色晶体↓ 白↓ 白↓ 出现白色晶体 出现白色晶体 Li+ + F- = LiF↓ 2Li+ + CO2 3 − = Li2CO3↓ 3Li+ + HPO2 4 − = Li3PO4↓+ H + Na+ + KSb(OH)6 = Sb(OH)6Na↓ + K + K + + NaHC4H4O6 = KHC4H4O6↓+ Na+ 思考题