
《无机化学B》教学大纲 课程类别:学科基础 课程性质:必修 英文名称:Inorganic Chemistry A 总学时:48学时 学分:3 先修课程: 适用专业:医学检验、中药学 开课单位:环境与化学工程学院基础化学教研室 一、课程简介 无机化学是医学院的第一门化学课,它包括化学热力学基础、化学反应速率、化 学平衡、酸碱平衡、氧化还原反应、原子结构、分子结构等部分。通过学习使学生掌 握无机化学基本理论,基本计算和基本实验技能,以便更好地了解这些基本理论 基本计算和基本实验技能在医学检验专业中的应用,并为学习后续课程打下基础, 达到培养学生分析问题和解决问题的能力。 二、教学内容及基本要求 第一章绪论 (2学时) 教学内容: 1.1无机化学的发展和研究内容 1.2化学与药学 1.3无机化学的学习方法1.4中国法定计量单位 1.5有效数字及运算法则 教学要求: 1.初步了解无机化学所包含的内容和相应的学习方法。 2.进一步明确计量单位及有效数字运算。 授课方式:讲授 第二章溶液 (4学时) 教学内容: 2.1溶液的浓度 2.2稀溶液的依数性2.3电解质在水溶液中的存在状态 教学要求: L.熟悉溶液相关浓度的计算方法2.掌握稀溶液的依数性 3.明确强电解质溶液理论 授课方式:讲授 第三章化学反应速率 (4学时) 教学内容 3.1化学反应速率和反应机理3.2反应速率理论简介 3.3影响反应速率的因素 教学要求: 1.学会化学反应速率及其表示方法。2.掌握浓度对反应速率的影响
11 《无机化学 B》教学大纲 课程类别:学科基础 课程性质:必修 英文名称:Inorganic Chemistry A 总学时: 48 学时 学分:3 先修课程: 无 适用专业: 医学检验、中药学 开课单位: 环境与化学工程学院 基础化学教研室 一、课程简介 无机化学是医学院的第一门化学课,它包括化学热力学基础、化学反应速率、化 学平衡、酸碱平衡、氧化还原反应、原子结构、分子结构等部分。通过学习使学生掌 握无机化学基本理论,基本计算和基本实验技能,以便更好地了解这些基本理论、 基本计算和基本实验技能在医学检验专业中的应用,并为学习后续课程打下基础, 达到培养学生分析问题和解决问题的能力。 二、教学内容及基本要求 第一章 绪论 ( 2 学时 ) 教学内容: 1.1 无机化学的发展和研究内容 1.2 化学与药学 1.3 无机化学的学习方法 1.4 中国法定计量单位 1.5 有效数字及运算法则 教学要求: 1.初步了解无机化学所包含的内容和相应的学习方法。 2.进一步明确计量单位及有效数字运算。 授课方式:讲授 第二章 溶液 ( 4 学时 ) 教学内容: 2.1 溶液的浓度 2.2 稀溶液的依数性 2.3 电解质在水溶液中的存在状态 教学要求: 1. 熟悉溶液相关浓度的计算方法 2. 掌握稀溶液的依数性。 3. 明确强电解质溶液理论 授课方式:讲授 第三章 化学反应速率 (4 学时) 教学内容: 3.1 化学反应速率和反应机理 3.2 反应速率理论简介 3.3 影响反应速率的因素 教学要求: 1.学会化学反应速率及其表示方法。 2.掌握浓度对反应速率的影响

3.掌握温度对反应速率的影响。4.掌握催化剂对反应速率的影响 授课方式:讲授 第四章化学热力学初步 (6学时) 教学内容: 4.1热力学第一定律 4.2化学反应的热效应 4.3吉布斯能和化学反应的方向 教学要求: 1.了解一些常用术语。2.掌握热力学第一定律。 3.学会热力学方程的写法。4.掌握热力学第二定律 5.学会吉布斯自由能及其应用。 授课方式:讲授 第五章化学平衡 (4学时 教学内容: 5.1平衡常数5.2化学平衡的移动 敦学要求: 1.学会化学平衡常数的计算。2.掌握多重平衡。3.熟悉化学平衡的移动。 授课方式:讲授 第六章酸碱平衡 (4学时 教学内容: 6.1酸碱理论 6.2水的质子自递平管 6.3弱酸弱减电离平衡6.4缓冲溶液 教学要求: 1,了解弱电解质的解离平衡。2.掌握溶液的PH的计算方法。 3.掌握缓冲溶液PH的计算方法。4.熟悉酸碱理论。 授课方式:讲授 第七章难溶电解质的沉淀溶解平衡 (4学时) 教学内容: 7.1溶度积原理 7.2难溶电解质的沉淀和溶解平衡。 敦学要求: 1,学会沉淀溶解平衡和溶度积的计算方法。 。2.熟悉沉淀的生成和溶解 3.明确沉淀的转化和分步沉淀。 授课方式:讲授 第八章氧化还原反应 (4学时) 教学内容: 8.1氧化还原反应的实质。8.2电池的电动势和电极电势。 8.3氧化还原平衡。8.4影响电极电势的因素。8.5元素电势图及其应用 教学要求: 1.熟悉氧化还原反应的基本概念。2.掌握氧化还原反应方程式配平的方法
12 3.掌握温度对反应速率的影响。 4.掌握催化剂对反应速率的影响。 授课方式:讲授 第四章 化学热力学初步 ( 6 学时 ) 教学内容: 4.1 热力学第一定律 4.2 化学反应的热效应 4.3 吉布斯能和化学反应的方向 教学要求: 1.了解一些常用术语。 2.掌握热力学第一定律。 3.学会热力学方程的写法。 4.掌握热力学第二定律。 5.学会吉布斯自由能及其应用。 授课方式:讲授 第五章 化学平衡 (4 学时) 教学内容: 5.1 平衡常数 5.2 化学平衡的移动 教学要求: 1.学会化学平衡常数的计算。 2.掌握多重平衡。 3.熟悉化学平衡的移动。 授课方式:讲授 第六章 酸碱平衡 (4 学时) 教学内容: 6.1 酸碱理论 6.2 水的质子自递平衡 6.3 弱酸弱减电离平衡 6.4 缓冲溶液 教学要求: 1.了解弱电解质的解离平衡。 2.掌握溶液的 PH 的计算方法。 3.掌握缓冲溶液 PH 的计算方法。 4.熟悉酸碱理论。 授课方式:讲授 第七章 难溶电解质的沉淀溶解平衡 (4 学时) 教学内容: 7.1 溶度积原理。 7.2 难溶电解质的沉淀和溶解平衡。 教学要求: 1.学会沉淀溶解平衡和溶度积的计算方法。 2.熟悉沉淀的生成和溶解。 3.明确沉淀的转化和分步沉淀。 授课方式:讲授 第八章 氧化还原反应 ( 4 学时 ) 教学内容: 8.1 氧化还原反应的实质。 8.2 电池的电动势和电极电势。 8.3 氧化还原平衡。 8.4 影响电极电势的因素。 8.5 元素电势图及其应用。 教学要求: 1.熟悉氧化还原反应的基本概念。2.掌握氧化还原反应方程式配平的方法

3.学会电极电势的计算。4.明确电极电势应用。5.学会元素电势图及应用。 授课方式:讲授 第九章原子结构 (6学时)》 教学内容: 9.1玻尔的氢原子模型9.2氢原子的量子力学模型 9.3名电子原子结构 9.4电子层结构与元素周期表 9.5元素基本性质的周期性 教学要求: 1.了解微观粒子的波粒二象性。 2.掌握氢原子核外电子的运动状态 3.掌握多电子原子核外电子的运动状态。4.学会原子结构和元素周期律。 授课方式:讲授 第十章分子结构 (6学时) 教学内容: 10.1离子键10.2共价键10.3分子结构与物理性质 10.4分子间作用力10.5离子极化10.6晶体结构 教学要求: 1.掌握离子键和共价键的概念。2.熟悉轨道杂化理论 3.了解价层电子对互斥理论。4.了解分子轨道理论。 5.掌握分子的极性和分子间力。6.学会离子极化和氢键及晶体结构 授课方式:讲授 第十一章配位化合物 (4学时) 教学内容: 11.1配合物的组成、命名和异构现象11.2配合物的化学键理论 11.3配位平衡11.4生物体内的配合物和配合物药物 教学要求: 1.熟悉配位化合物的组成和定义。2.学会配位化合物类型和命名。 3.了解配位化合物的化学键本性。4,了解配位解离平衡。 5.了解整合物的稳定性。 6.学会配合物在生物、医学等方面的应用。 授课方式:讲授 三、其他教学环节安排 本课程实验教学另行安排。 四、考核方式 本课程成绩根据作业、实验和期末考试成绩进行评定,课程成绩以百分制计 算,分配比例如下: (1)平时成绩20%。其中实验成绩10%,作业和出勤10%。 (2)期末成绩:闭卷笔试,占总成绩80%。 五、教材及主要参考书 1.教材:许善锦主编,《无机化学》(第四版),人民卫生出版社,2000 3
13 3.学会电极电势的计算。4.明确电极电势应用。5.学会元素电势图及应用。 授课方式:讲授 第九章 原子结构 (6 学时) 教学内容: 9.1 玻尔的氢原子模型 9.2 氢原子的量子力学模型 9.3 多电子原子结构 9.4 电子层结构与元素周期表 9.5 元素基本性质的周期性 教学要求: 1.了解微观粒子的波粒二象性。 2.掌握氢原子核外电子的运动状态。 3.掌握多电子原子核外电子的运动状态。 4.学会原子结构和元素周期律。 授课方式:讲授 第十章 分子结构 (6 学时) 教学内容: 10.1 离子键 10.2 共价键 10.3 分子结构与物理性质 10.4 分子间作用力 10.5 离子极化 10.6 晶体结构 教学要求: 1.掌握离子键和共价键的概念。 2.熟悉轨道杂化理论。 3.了解价层电子对互斥理论。 4.了解分子轨道理论。 5.掌握分子的极性和分子间力。 6.学会离子极化和氢键及晶体结构。 授课方式:讲授 第十一章 配位化合物 (4 学时) 教学内容: 11.1 配合物的组成、命名和异构现象 11.2 配合物的化学键理论 11.3 配位平衡 11.4 生物体内的配合物和配合物药物 教学要求: 1.熟悉配位化合物的组成和定义。 2.学会配位化合物类型和命名。 3.了解配位化合物的化学键本性。 4.了解配位解离平衡。 5.了解螯合物的稳定性。 6.学会配合物在生物、医学等方面的应用。 授课方式:讲授 三、其他教学环节安排 本课程实验教学另行安排。 四、考核方式 本课程成绩根据作业、实验和期末考试成绩进行评定,课程成绩以百分制计 算,分配比例如下: (1)平时成绩 20%。其中实验成绩 10%,作业和出勤 10%。 (2)期末成绩:闭卷笔试,占总成绩 80%。 五、教材及主要参考书 1.教材:许善锦主编,《无机化学》(第四版),人民卫生出版社,2000

2.主要参考书: (1)铁步荣、贾桂芝主编,《无机化学习题集》,中国中医药出版社,2008.9 (2)徐春祥主编。《基础化学》.高等教有出版社,2003.8 (3)大连理工大学无机化学教研室主编。《无机化学》(第五版),高等教育 出版社,2006.9 撰写人:李昕跃 审核人:尤慧艳 课程负责人:尤慧艳 14
14 2.主要参考书: (1)铁步荣、贾桂芝主编,《无机化学习题集》,中国中医药出版社,2008.9 (2)徐春祥主编.《基础化学》.高等教育出版社,2003.8 (3)大连理工大学无机化学教研室主编.《无机化学》(第五版),高等教育 出版社,2006.9 撰写人:李昕跃 审核人:尤慧艳 课程负责人:尤慧艳
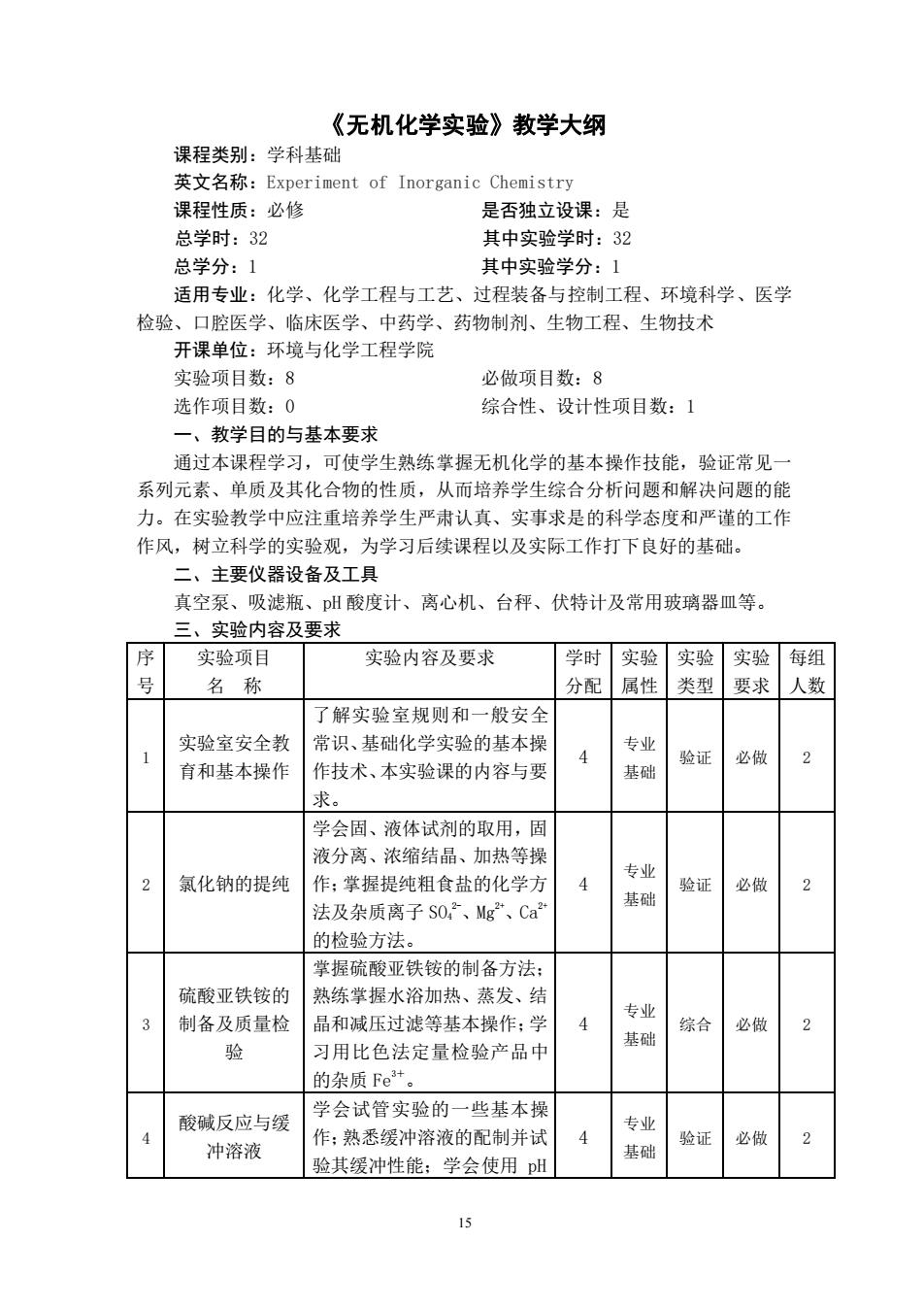
《无机化学实验》教学大纲 课程类别:学科基础 英文名称:Experiment of Inorganic Chemistry 课程性质:必修 是否独立设课:是 总学时:32 其中实验学时:32 总学分:1 其中实验学分:1 适用专业:化学、化学工程与工艺、过程装备与控制工程、环境科学、医学 检验、口腔医学、临床医学、中药学、药物制剂、生物工程、生物技术 开课单位:环境与化学工程学院 实验项目数:8 必做项目数:8 选作项目数:0 综合性、设计性项目数:1 一、教学目的与基本要求 通过本课程学习,可使学生熟练掌握无机化学的基本操作技能,验证常见 系列元素、单质及其化合物的性质,从而培养学生综合分析问题和解决问题的能 力。在实验教学中应注重培养学生严肃认真、实事求是的科学态度和严谨的工作 作风,树立科学的实验观,为学习后续课程以及实际工作打下良好的基础。 二、主要仪器设备及工具 真空泵、吸滤瓶、pH酸度计、离心机、台秤、伏特计及常用玻璃器皿等。 三、实验内容及要求 序 实验项目 实验内容及要求 学时实验实验实验每组 号 名称 分配属性 类型 要求人数 了解实验室规则和一般安全 实验室安全教 常识、基础化学实验的基本操 专业 1 4 验证 必做 2 育和基本操作 作技术、本实验课的内容与要 基础 求。 学会固、液体试剂的取用,固 液分离、浓缩结晶、加热等操 2 氯化钠的提纯 作:掌握提纯粗食盐的化学方 4 专业 验证 必做 2 基础 法及杂质离子S0,2、Mg“、Ca 的检验方法 掌握硫酸亚铁铵的制备方法: 硫酸亚铁铵的 熟练掌握水浴加热、蒸发、结 专业 制备及质量检 晶和减压过滤等基本操作:学 4 综合 基础 必做 2 验 习用比色法定量检验产品中 的杂质Fe+ 酸碱反应与缓 学会试管实验的一些基本操 专业 4 冲溶液 作:熟悉缓冲溶液的配制并试 基础 验证 必做 2 验其缓冲性能:学会使用pH
15 《无机化学实验》教学大纲 课程类别:学科基础 英文名称:Experiment of Inorganic Chemistry 课程性质:必修 是否独立设课:是 总学时:32 其中实验学时:32 总学分:1 其中实验学分:1 适用专业:化学、化学工程与工艺、过程装备与控制工程、环境科学、医学 检验、口腔医学、临床医学、中药学、药物制剂、生物工程、生物技术 开课单位:环境与化学工程学院 实验项目数:8 必做项目数:8 选作项目数:0 综合性、设计性项目数:1 一、教学目的与基本要求 通过本课程学习,可使学生熟练掌握无机化学的基本操作技能,验证常见一 系列元素、单质及其化合物的性质,从而培养学生综合分析问题和解决问题的能 力。在实验教学中应注重培养学生严肃认真、实事求是的科学态度和严谨的工作 作风,树立科学的实验观,为学习后续课程以及实际工作打下良好的基础。 二、主要仪器设备及工具 真空泵、吸滤瓶、pH 酸度计、离心机、台秤、伏特计及常用玻璃器皿等。 三、实验内容及要求 序 号 实验项目 名 称 实验内容及要求 学时 分配 实验 属性 实验 类型 实验 要求 每组 人数 1 实验室安全教 育和基本操作 了解实验室规则和一般安全 常识、基础化学实验的基本操 作技术、本实验课的内容与要 求。 4 专业 基础 验证 必做 2 2 氯化钠的提纯 学会固、液体试剂的取用,固 液分离、浓缩结晶、加热等操 作;掌握提纯粗食盐的化学方 法及杂质离子 SO4 2-、Mg2+、Ca2+ 的检验方法。 4 专业 基础 验证 必做 2 3 硫酸亚铁铵的 制备及质量检 验 掌握硫酸亚铁铵的制备方法; 熟练掌握水浴加热、蒸发、结 晶和减压过滤等基本操作;学 习用比色法定量检验产品中 的杂质 Fe3+。 4 专业 基础 综合 必做 2 4 酸碱反应与缓 冲溶液 学会试管实验的一些基本操 作;熟悉缓冲溶液的配制并试 验其缓冲性能;学会使用 pH 4 专业 基础 验证 必做 2