
F=[P(S-1)+2]-[S(P-1)+R+R]=S-R-R'-P+2 自由度数 F=C-P+2 F=C-P+n 讨论 1.相律只适用于相平衡系统: 2.推导过程假设$种物质存在于P相的每一相中,若 实际情况不符和仍可适用。 3.F=C-P+n,n=2中的2”通常表示温度、压力; 4对只有液、固相的凝聚系统,忽略压力影响。 F=C-P+1。(C=S-R-R') 5.相律的意义:利用相律来确定描述相平衡系统所 需要的独立变量个数
F=[P(S-1)+2]-[S(P-1)+R+R′]=S-R-R′-P+2 自由度数 F=C-P+2 讨论 5.相律 的意义:利用相律 来确定描述相平衡系统所 需要的独立变量个数。 1.相律 只适用于相平衡系统; 2.推导过程假设 S种物质存在于 P相的每一相中,若 实际情况不符和仍可适用。 3.F=C-P+n, n=2中的“2” 通常表示温度、压力; 4.对只有液、固相的凝聚系统,忽略压力影响。 F=C-P+1 。( C=S-R-R′) F=C-P+n

§6-2 单组分系统相图 相律分析 F=C-P+2 单组分系统:C=1,F=1-P+2=3-P P最小为1,自由度最大为2:自由度最小为0,P最大为3。 1、单组分单相系统:F=2,有两个独立的变量, T、P。可以用面表示系统状态。 2、单组分两相系统:F=1,有一个独立的变量, T、P有数量关系。可以用线表示系统状态。 3、单组三相系统:F=0,无独立的变量, T、P有确定值。可以用点表示系统状态
§6-2 单组分系统相图 相律 分析 F=C-P+2 单组分系统:C=1,F=1-P+2=3-P 1、单组分单相系统:F=2,有两个独立的变量, T、P。可以用面表示系统状态。 2、单组分两相系统:F=1,有一个独立的变量, T、P有数量关系。可以用线表示系统状态。 3、单组三相系统:F=0,无独立的变量, T、P有确定值。可以用点表示系统状态。 P最小为1,自由度最大为2;自由度最小为0,P最大为3

结论 1、单组分系统自由度最小F=0,不能存在四相平衡: 2、单组分系统自由度最大F=2,可以用平面坐标描述。 单组分系统平衡相图 平衡相态: 双变量系统(单相) 单变量系统(两相)无变量系统(三相) 冰 冰·一→水 水 冰·一→水蒸气 冰一→水一→水蒸气 水蒸气 水水蒸气
结论 1、单组分系统自由度最小F=0,不能存在四相平衡; 2、单组分系统自由度最大F=2,可以用平面坐标描述。 单组分系统平衡相图 单组分系统平衡相图 平衡相态: 双变量系统(单相) 单变量系统(两相)无变量系统(三相) 冰 水 水蒸气 冰 水 冰 水蒸气 水 水蒸气 冰 水 水蒸气
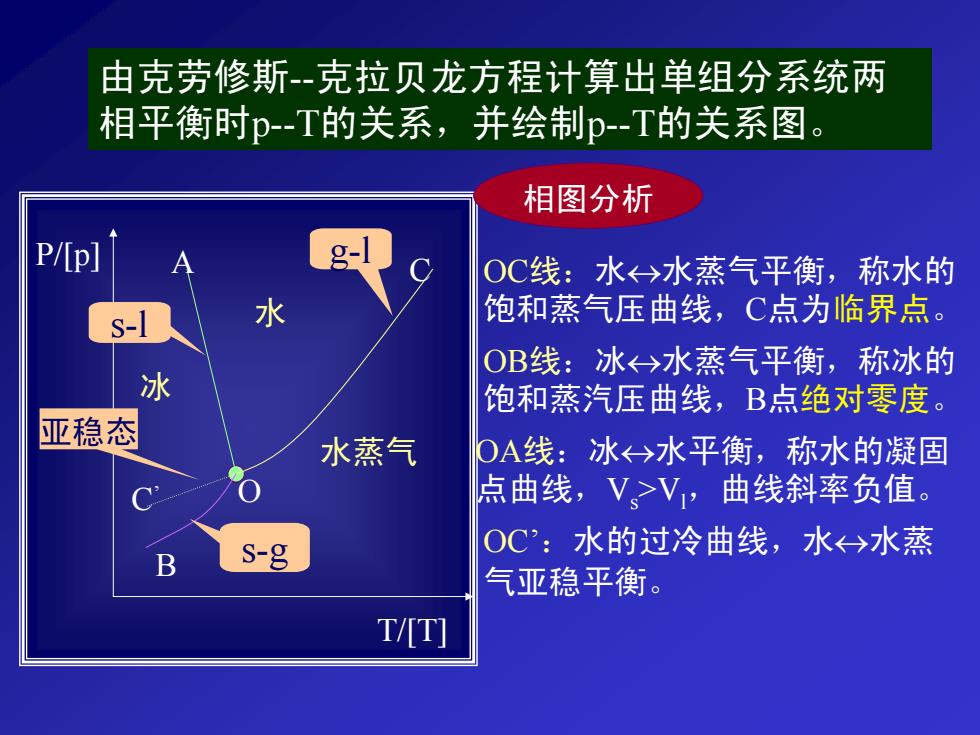
由克劳修斯-克拉贝龙方程计算出单组分系统两 相平衡时p-T的关系,并绘制p-T的关系图。 相图分析 P/p] g- OC线:水←>水蒸气平衡,称水的 水 饱和蒸气压曲线,C点为临界点。 OB线:冰←>水蒸气平衡,称冰的 冰 饱和蒸汽压曲线,B点绝对零度。 亚稳态 水蒸气 OA线:冰←→水平衡,称水的凝固 点曲线,V>V,曲线斜率负值。 S-g OC:水的过冷曲线,水今水蒸 B 气亚稳平衡。 TT]
由克劳修斯--克拉贝龙方程计算出单组分系统两 相平衡时p--T的关系,并绘制p--T的关系图。 P/[p] T/[T] A C B C’ O 水 冰 水蒸气 相图分析 OC线:水↔水蒸气平衡,称水的 饱和蒸气压曲线,C点为临界点。 OB线:冰↔水蒸气平衡,称冰的 饱和蒸汽压曲线,B点绝对零度。 OA线:冰↔水平衡,称水的凝固 点曲线,Vs>Vl,曲线斜率负值。 OC’:水的过冷曲线,水↔水蒸 气亚稳平衡。 g-l s-l s-g 亚稳态

O点:三相点,无变量,水<→冰←→水蒸气三相平衡斯, p=0.610kPa,T=0.01℃。 讨论 静分析: 1、 图中分三块区域,分别代表三个不同的单相 区,即液、固、汽,每个区域为双变量区。 2、图中三条线代表着三个两相平衡单变量系统。 3、三相点与冰的区别: 三相点p=0.610kPa,T=0.01℃,纯物质三相平衡: 冰点p-101.325kPa,T=0℃,饱和了空气的 水←→冰平衡。 动分析:
O点:三相点,无变量,水↔冰↔水蒸气三相平衡, p=0.610kPa,T=0.01℃。 讨论 静分析: 1、图中分三块区域,分别代表三个不同的单相 区,即液、固、汽,每个区域为双变量区。 2、图中三条线代表着三个两相平衡单变量系统。 3、三相点与冰的区别: 三相点p=0.610kPa,T=0.01℃,纯物质三相平衡; 冰点p=101.325kPa,T=0℃,饱和了空气的 水↔ 冰平衡。 动分析: