
基础自主梳理 (2)盐酸和硫酸的用途。 ①盐酸是重要的化工产品,用于金属表面 除锈、制 造药物等;人体胃液中含有 盐酸,可帮助消化。 ②疏酸是重要的化工原料,用于生产化肥、农药等以及冶炼 金属、精炼石油和金属除锈等。浓硫酸具有吸水性,在 实验室里常用作干燥剂。 导航页
导航页 基础自主梳理 (2)盐酸和硫酸的用途。 ①盐酸是重要的化工产品,用于金属表面___________、制 造药物等;人体胃液中含有___________,可帮助消化。 ②硫酸是重要的化工原料,用于生产化肥、农药等以及冶炼 金属、精炼石油和金属除锈等。浓硫酸具有___________,在 实验室里常用作干燥剂。 除锈 盐酸 吸水性
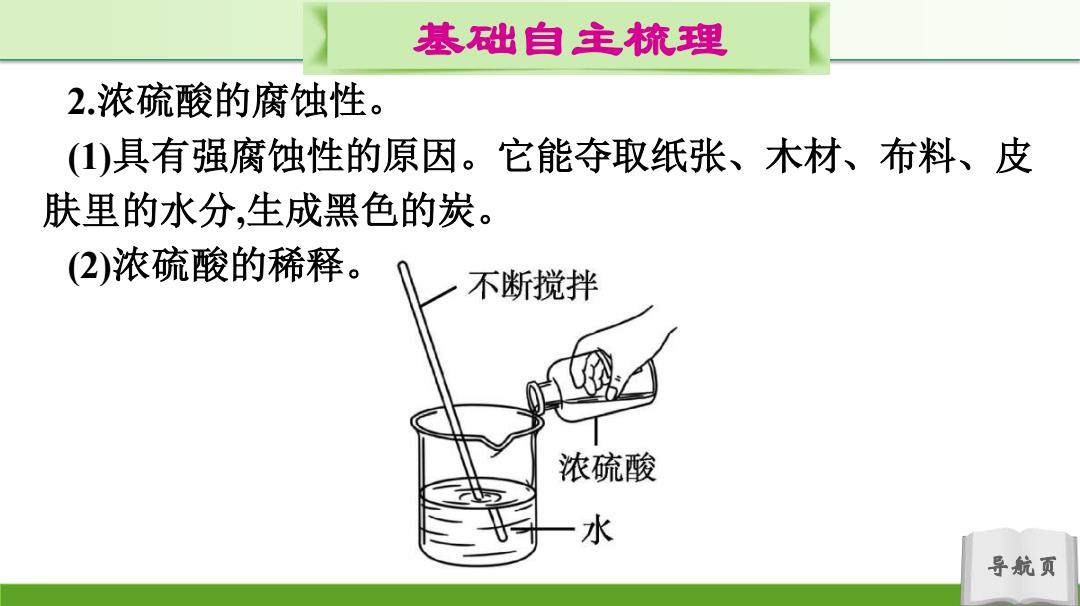
基础自主梳理 2.浓疏酸的腐蚀性。 (1)具有强腐蚀性的原因。它能夺取纸张、木材、布料、皮 肤里的水分,生成黑色的炭。 (2)浓硫酸的稀释。 不断搅拌 浓硫酸 水 导航页
导航页 基础自主梳理 2.浓硫酸的腐蚀性。 (1)具有强腐蚀性的原因。它能夺取纸张、木材、布料、皮 肤里的水分,生成黑色的炭。 (2)浓硫酸的稀释

基础自主梳理 3.酸的化学性质。 (1)与酸碱指示剂的反应。酸能使紫色石蕊溶液 变红 使无色酚酞溶液不变色。 导航页
导航页 基础自主梳理 3.酸的化学性质。 (1)与酸碱指示剂的反应。酸能使紫色石蕊溶液__________, 使无色酚酞溶液___________。 变红 不变色
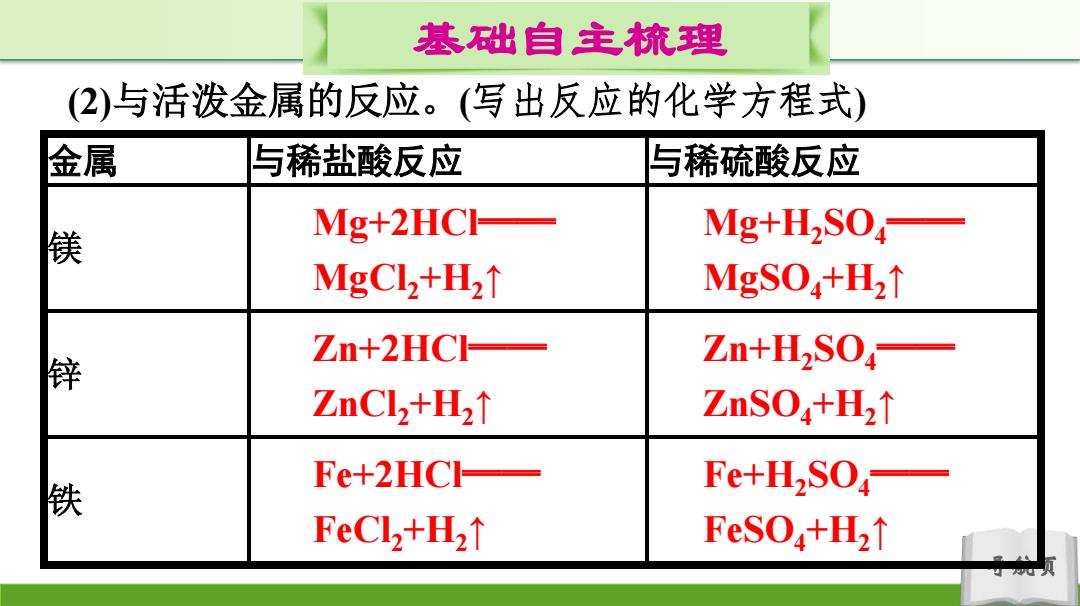
基础自主梳理 (2)与活泼金属的反应。(写出反应的化学方程式) 金属 与稀盐酸反应 与稀硫酸反应 镁 Mg+2HCH- Mg+H2S04— MgCl2+H2↑ MgSO+H2↑ Zn+2HC— 锌 Zn+H2S04— ZnCl2+H2↑ ZnSO4+H2↑ Fe+2HCI- 铁 Fe+H2SO FeCl2+H2 FeSO+H↑ 人
导航页 基础自主梳理 (2)与活泼金属的反应。(写出反应的化学方程式) 金属 与稀盐酸反应 与稀硫酸反应 镁 锌 铁 Mg+2HCl══ MgCl2+H2↑ Mg+H2SO4 ══ MgSO4+H2↑ Zn+2HCl══ ZnCl2+H2↑ Zn+H2SO4 ══ ZnSO4+H2↑ Fe+2HCl══ FeCl2+H2↑ Fe+H2SO4 ══ FeSO4+H2↑
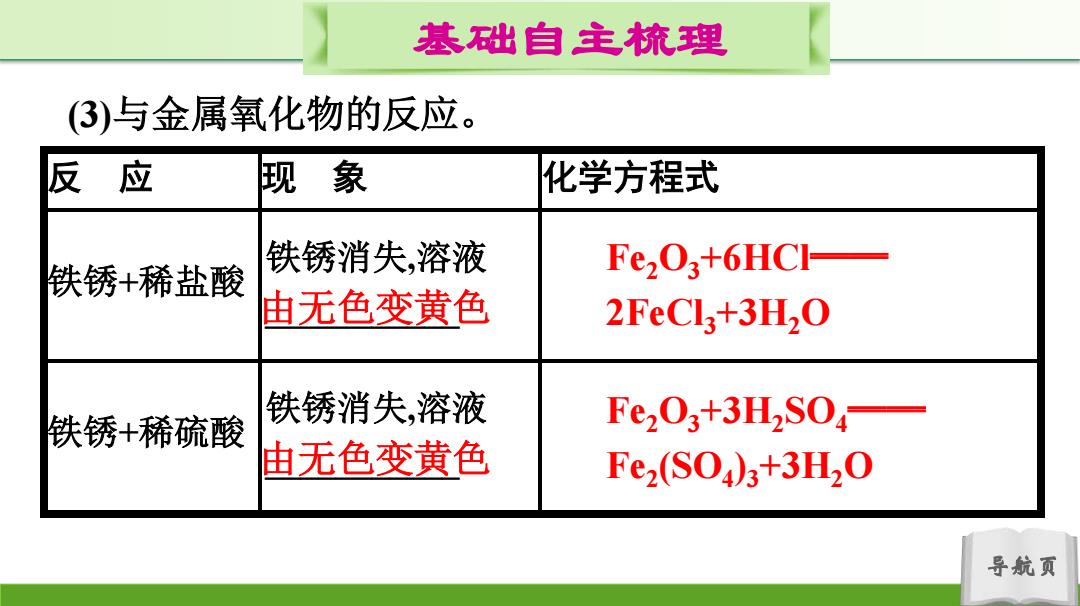
基础自主梳理 (3)与金属氧化物的反应。 反应 现象 化学方程式 铁锈消失,溶液 铁锈+稀盐酸 Fe2O3+6HCI- 由无色变黄色 2FeCl3+3H2O 铁锈消失,溶液 铁锈+稀硫酸 Fe203+3H2S0,— 由无色变黄色 Fez(S04)3+3H20 导航页
导航页 基础自主梳理 (3)与金属氧化物的反应。 反 应 现 象 化学方程式 铁锈+稀盐酸 铁锈消失,溶液 ___________ 铁锈+稀硫酸 铁锈消失,溶液 ___________ 由无色变黄色 Fe2O3+6HCl══ 2FeCl3+3H2O 由无色变黄色 Fe2O3+3H2SO4 ══ Fe2 (SO4 )3+3H2O