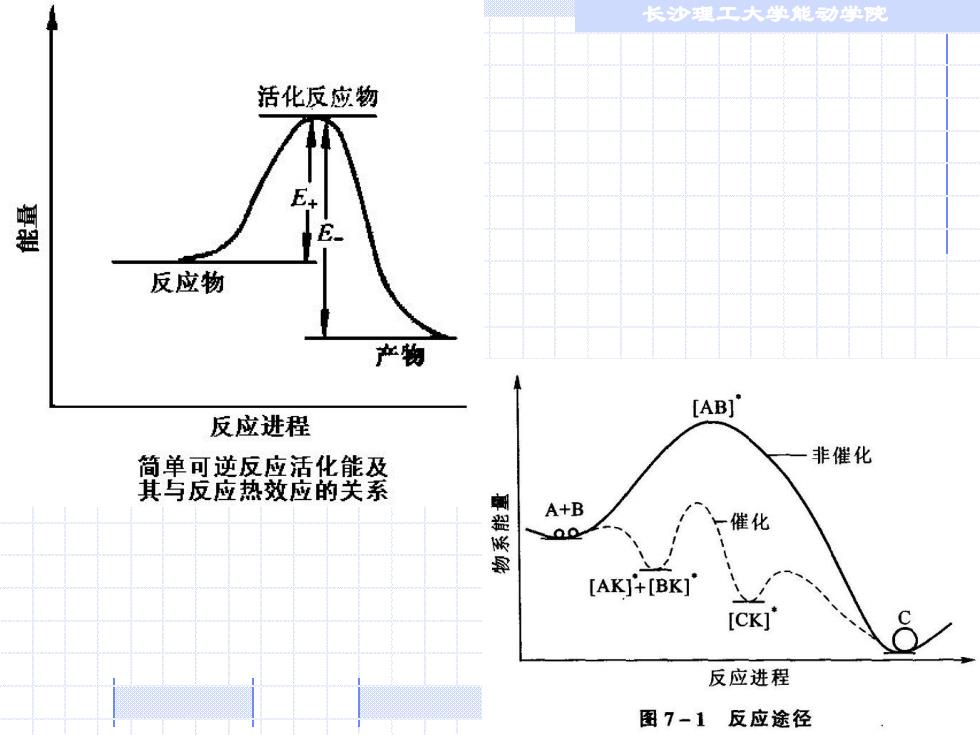
长沙理工大单能动学完 活化反应物 反应物 产物 [ABI' 反应进程 简单可逆反应活化能及 非催化 其与反应热效应的关系 A+B 00 催化 [AK]+[BK] [CK]' 反应进程 图7-1反应途径
长沙理工大学能动学院

长沙理工大学能动学克 5.连锁反应 化学反应中会自动生成一系列新的活化中心、使反应由许多中间过程组成 即连锁反应。如500。C时氢的燃烧, 链的激发过程,形成初始活化分子 链的传递过程,活化分子与反应物反应,并生成新的活化分子 链的断裂过程,活化分子与器壁碰撞失去能量, 活化分子消失 Cl+hv→2C1+h 不分支连锁反应 C12+H2→2HC1 C1+H2→HC1+H i+CL,→HC1+C C1+H2→HC1+i 分支连锁反应 H2+M→2H+M 2H2+O,→2HO H+O,→OH+0(吸热反应) O+H2→OH+H(放热反应) H+3H,+O,>3H+2H,O OH+H2→H,O+A(放热反应 OH+H2→H,O+户(放热反应
长沙理工大学能动学院 • 链的激发过程,形成初始活化分子 • 链的传递过程,活化分子与反应物反应,并生成新的活化分子 • 链的断裂过程,活化分子与器壁碰撞失去能量,活化分子消失 Cl H 2HCl 不分支连锁反应 2 2 Cl H HCl H H Cl HCl Cl Cl H HCl H Cl h Cl h 2 2 2 2 2 分支连锁反应 2H2 O2 2H2O (放热反应) (放热反应) (放热反应) (吸热反应) OH H H O H OH H H O H O H OH H H O OH O H M H M 2 2 2 2 2 2 2 2 H 3H2 O2 3H 2H2O

长沙理工大学能动学陕 氧的扩散速度 Wks =aks(Co-CB) C。一—气体中平均氧浓度 CB 固体炭粒表面氧浓度 边界层 (Nu) aksd 反应产物灰层 D 未燃烧碳核 (Nw)g=2(1+0.08Re) O RR Rp
长沙理工大学能动学院 ( ) wks ks C0 CB D d Nu O ks ks 2 ( ) 2 ( )O ks Nu ks d D ( ) 2(1 0.08Re ) 3 2 2 O N ks u Co——气体中平均氧浓度 CB——固体炭粒表面氧浓度

影响氧的扩散速度的因素 气流扩散能力决定于氧气浓度,氧的扩散速度遵循如下关系式: Ws=&(C。-CB) 表征氧气扩散速度的量; Cks 扩散速度常数主要取决于气流速度; Co 炭周围介质中的氧气浓度。 CB 炭表面的氧气浓度 2 W W为气流和炭粒的相对速度,炭粒直径是d 1 d3 三.燃烧速度与燃烧区域
长沙理工大学能动学院 气流扩散能力决定于氧气浓度,氧的扩散速度遵循如下关系式: B ks ks ks B C C W C C 0 0 扩散速度常数 表征氧气扩散速度的量; 炭表面的氧气浓度 炭周围介质中的氧气浓度。 主要取决于气流速度; 3 1 3 2 d W ks W 为气流和炭粒的相对速度,炭粒直径是 d 三.燃烧速度与燃烧区域

长沙理工大单能动学完 边界层 反应产物灰层 气相有效膜层厚度 未燃烧碳核 相分压 滞流内层厚度 H 滞流内层 相界面 固相 气相主气流 ORcR Rp ZG 距离: 02 传质的有效滞流膜层 a) CO. 1.分子扩散 2.湍流扩散 气流方向 3.对流扩散 4.碳燃烧中的扩散 Re>100 T=800~1200℃
长沙理工大学能动学院