
Ecrlor=Eolor+0.0591g [Cw2+] [Cu*] =F8-1a+0.059吗KmcU可 c2≈l→Cc2+≈[Cu2+] 又已知Kpo=1.1×102,令I]=l1mol/L sBga=2ram+0.0598K 1=0.87V 16
1 [ ] 2 2 2 + + C + Cu Cu Cu K I mol L CuI s p 1.1 10 [ ] 1 / 1 2 = = 又已知 − ,令 − V K E E CuI s p Cu Cu Cu Cu 0.87 1 2 2 0.059lg ' + + = + + + = 16 [ ] [ ] 0.059lg 2 2 2 + + + + = + + + Cu Cu E E Cu Cu Cu Cu [ ] 0.059lg ( ) 2 2 2 − + + = + + + K I C E S P CuI Cu Cu Cu Cu

3.形成配合物 与氧化型形成配合物→E↓ 与还原型形成配合物→E个 与两者均形成配合物 氧化型配合物的稳定性>还原型配合物的稳定性→E↓ 还原型配合物的稳定性>氧化型配合物的稳定性→E个 17
3. 形成配合物 与两者均形成配合物 ' 氧化型配合物的稳定性 还原型配合物的稳定性 E ' 还原型配合物的稳定性 氧化型配合物的稳定性 E ' 与氧化型形成配合物 E ' 与还原型形成配合物 E 17
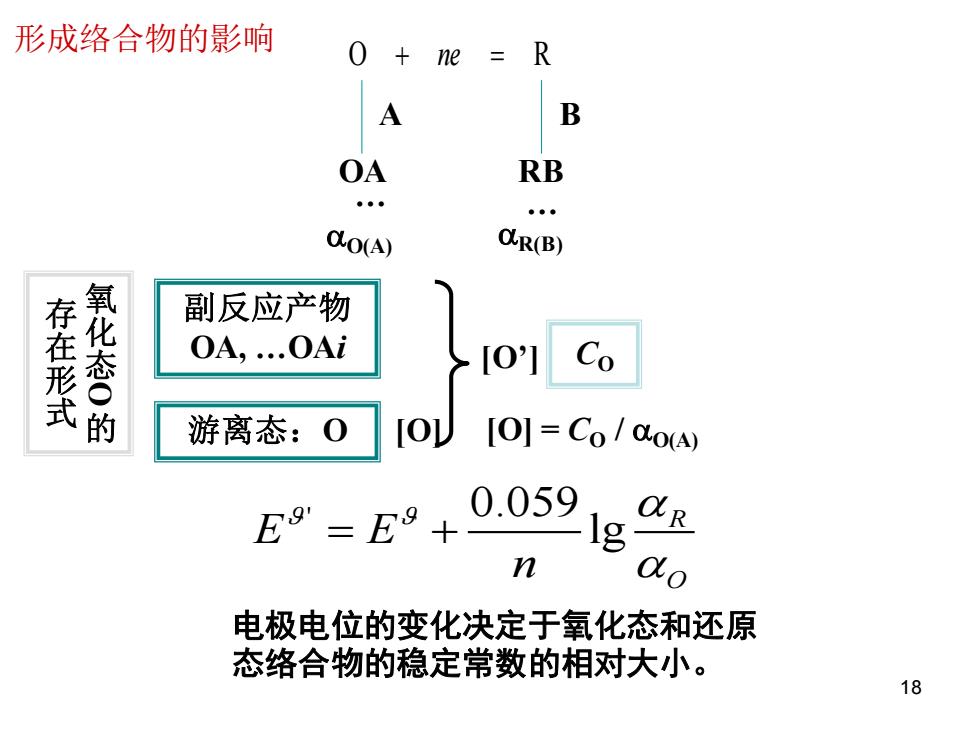
形成络合物的影响 0 ne =R A B OA RB O(A) CR(B) 存在形式 氧化态○的 副反应产物 0A,.0Ai [0] Co 游离态:O [O]=Co/Co(A) E9=E9+ 0.059 R n do 电极电位的变化决定于氧化态和还原 态络合物的稳定常数的相对大小。 18
O + ne = R A OA O(A) B RB R(B) 电极电位的变化决定于氧化态和还原 态络合物的稳定常数的相对大小。 . . ' 0.059 lg R O E E n = + 形成络合物的影响 18 副反应产物 OA, .OAi 游离态:O CO 氧 化 态O 的 存 在 形 式 [O] [O’] [O] = CO / O(A)

4.酸效应-酸度的影响 OH、Ht参与反应的电对Mn04+8H+5e=Mn2++4H20 弱酸碱参与反应的电对H3As04+2H++2e=H3As03+2H20 0.059 O+ne+mH =R R n do H H HiO HiR CO(H) CRH田 H3AsO+2 H++2e=HAsO2+2H2O 三0R3 1 8o Kai(O) K(R) 60 =E+0.0y1g+005yg6 19
4.酸效应-酸度的影响 OH-、H+参与反应的电对 MnO4 - + 8 H+ + 5e = Mn2+ + 4H2O 弱酸碱参与反应的电对 H3AsO4 + 2 H+ + 2e = H3AsO3 + 2H2O O+ + mH = R + ne H+ HjO H+ HiR O(H) . . R(H) ' 0.059 lg[H 0.059 ] lg R O E E n n + = + + Kai(O) Kai(R) H3AsO4 + 2 H+ + 2e = HAsO2+ 2H2O ' 0.059 lg[ 0 H ] .059 lg O R E E n m n + = + + O O R R 1 , 1 = = 19

例: H,AsO+2H++2e HAs02+2H,0E月,0fH=0.56 L3+2e=3I 87r=0.545V 己知H3AsO4的pKa1~pK3分别为2.7,7.0和11.5 HAsO,的pKa=9.2 059 g LH,AsOir'P 2 [HAsO2] =E9+0:059g aMso.[H'Ci4so 2 H3AsOs CHAso E=E°+0.059g9 aa,[H+]2 H:ASO 20
H3AsO4 + 2H+ + 2e HAsO2 + 2H2O I 3 - + 2 e 3I- 例: EH AsO HAsO 0.56V 3 4 2 = E V I I 0.545 / 3 − − = [ ] [ ][ ] lg 2 0.059 2 2 3 4 3 4 2 HAsO H AsO H EH AsO HAsO E + = + = + + 2 3 4 3 4 2 2 [ ] lg 2 0.059 HAsO H AsO H AsO HAsO C H C E 3 4 2 2 ' [ ] lg 2 0.059 H ASO HAsO H E E + = + 9.2 ~ 2.7 7.0 11.5 2 3 4 1 3 HAsO pKa = H AsO p Ka p Ka 的 已知 的 分别为 , 和 20