
20-1-2钛的重要化合物 钛有+Ⅱ、+Ⅲ、+V氧化态化合物。 一、钛(V)化合物 (1)二氧化钛T0,(两性) 天然二氧化钛称“金红石”,含杂质。 人工制备纯T0,俗称“钛白粉”,由于它在耐化学腐蚀性, 热稳定性、抗紫外线粉化及折射率高等方面所表现的良好性能, 是优良的白色涂料,着色力强,遮盖力强,化学稳定性好,优 于“锌白”(ZnO)和铅白(2PbC03Pb(OHD2)等白色 涂料。因而得到广泛应用
天然二氧化钛称“金红石”,含杂质。 人工制备纯TiO2俗称“钛白粉”,由于它在耐化学腐蚀性, 热稳定性、抗紫外线粉化及折射率高等方面所表现的良好性能, 是优良的白色涂料,着色力强,遮盖力强,化学稳定性好,优 于“锌白”(ZnO)和铅白(2PbCO3·Pb(OH)2)等白色 涂料。 因而得到广泛应用。 20-1-2 钛的重要化合物 钛有+Ⅱ、+Ⅲ、+Ⅳ氧化态化合物。 一、钛(Ⅳ)化合物 (1)二氧化钛TiO2(两性)
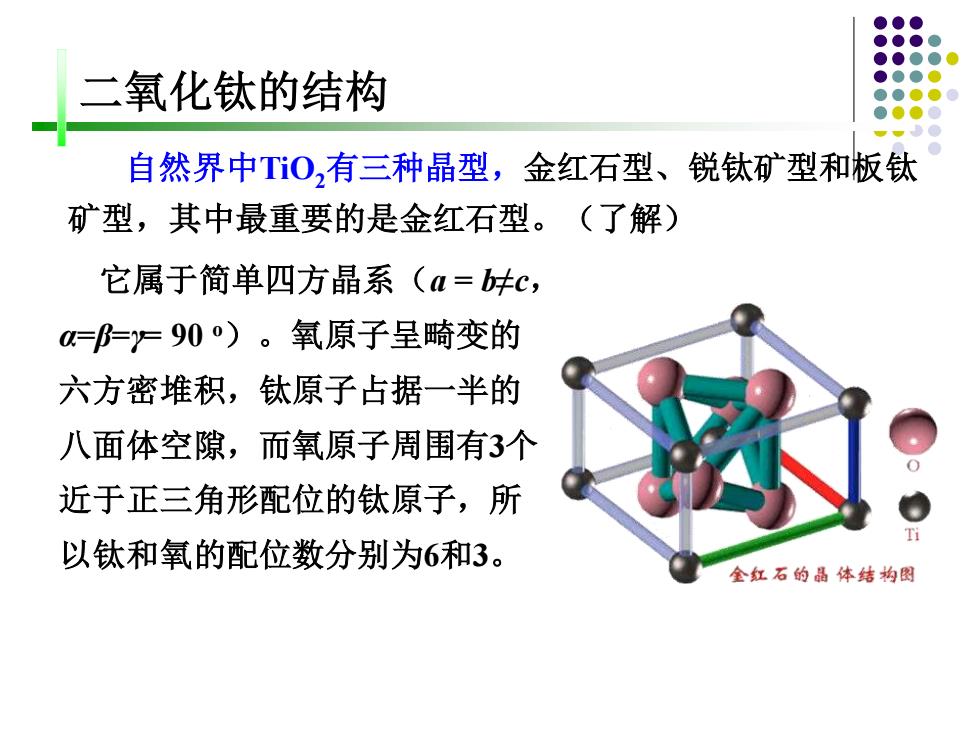
二氧化钛的结构 自然界中TO,有三种晶型,金红石型、锐钛矿型和板钛 矿型,其中最重要的是金红石型。(了解) 它属于简单四方晶系(a=.c, ===90)。氧原子呈畸变的 六方密堆积,钛原子占据一半的 八面体空隙,而氧原子周围有3个 近于正三角形配位的钛原子,所 以钛和氧的配位数分别为6和3。 金红石的晶体结构图
它属于简单四方晶系(a = b≠c, α=β=γ= 90 o)。氧原子呈畸变的 六方密堆积,钛原子占据一半的 八面体空隙,而氧原子周围有3个 近于正三角形配位的钛原子,所 以钛和氧的配位数分别为6和3。 自然界中TiO2有三种晶型,金红石型、锐钛矿型和板钛 矿型,其中最重要的是金红石型。(了解) 二氧化钛的结构
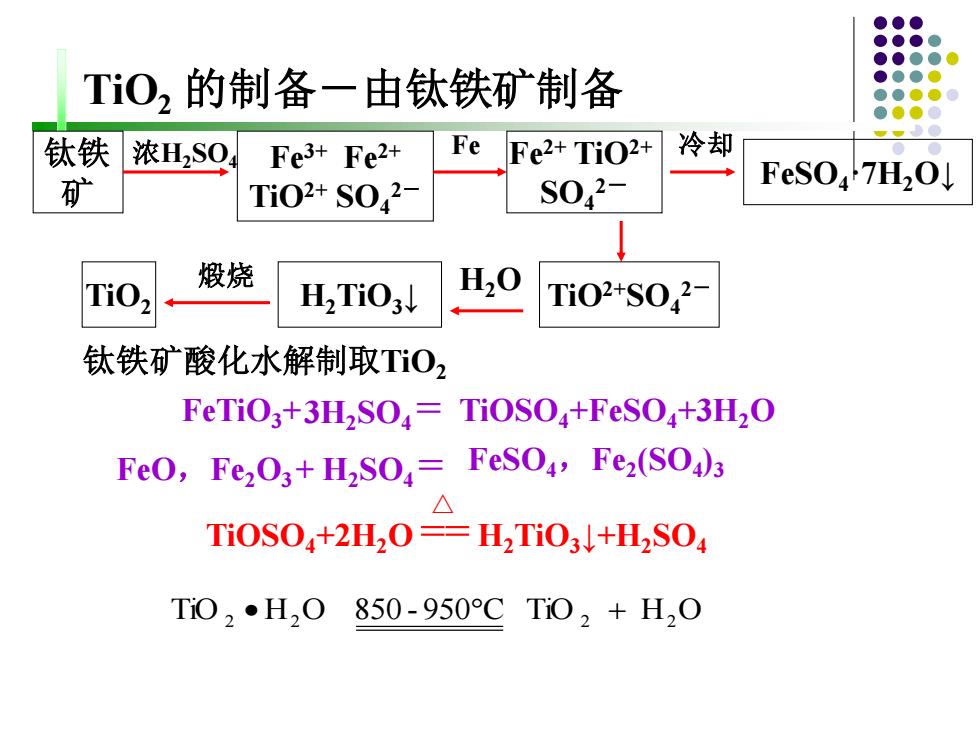
TO,的制备一由钛铁矿制备 钛铁 浓H2S0 Fe3+Fe2+ Fe Fe2+TiO2+ 冷却 矿 Ti02+S042 S042- FeSO7H2O 煅烧 H2Ti03↓ H20 Ti02+S042 钛铁矿酸化水解制取T02 FeTiO3+3H,SO,=TiOSO+FeSO+3H2O FeO,Fe2O3+H2SO=FeSO4,Fez(SO)3 Ti0S04+2H20=H2Ti03l+H2S04 Ti02●H20850-950CTi02+H20
钛铁 矿 浓H2SO4 FeTiO3+3H2SO4 = TiOSO4+FeSO4+3H2O FeO,Fe2O3 + H2SO4 = FeSO4,Fe2 (SO4 )3 Fe3+ Fe2+ TiO2+ SO4 2- Fe Fe2+ TiO2+ SO4 2- 冷却 FeSO4·7H2O↓ TiO2+SO4 H H2O 2- 2TiO3↓ TiOSO4+2H2O == H2TiO3↓+H2SO4 煅烧 TiO2 TiO2 的制备-由钛铁矿制备 TiO 2 • H2 O 850 - 950C TiO 2 + H2 O △ 钛铁矿酸化水解制取TiO2

氧化钛 。氧化钛为两性氧化物, 既溶于酸液溶于碱。 .TiO2 H2SO=TiOSO+H2O (Ti02+氧基 钛阳离子、钛酰离子) TiO2 +2NaOH=Na2TiO3 +H2O 钛酸有α、B两种类型。α型活泼性大,既溶于 酸,也溶于碱
⚫ 氧化钛为两性氧化物,既溶于酸液溶于碱。 ⚫ TiO2 + H2SO4 = TiOSO4 + H2O (TiO2+ 氧基 钛阳离子、钛酰离子) ⚫ TiO2 + 2NaOH = Na2TiO3 + H2O ⚫ 钛酸有α、β两种类型。α型活泼性大,既溶于 酸,也溶于碱。 氧化钛

(2) 四氯化钛TCL, a.共价化合物 固态为分子晶体,m.p.-24℃,b.p.136.5℃,R.T. 无色、有刺激性气味液体,可溶于有机溶剂。 b.极易水解→制烟雾弹。与SiCl4①水解相似。 TiCl(1)+(x+2)H2O(1)=TiO2xH2O(s)+4 HCI (g) T2+不存在(易氧化), TiC2、TiBr2晶体存在, T4+不存在(水解)
a. 共价化合物 固态为分子晶体,m.p.-24 ℃,b.p.136.5 ℃,R.T. 无色、有刺激性气味液体,可溶于有机溶剂。 b.极易水解 → 制烟雾弹。 与SiCl4 (l)水解相似。 TiCl4 (l) + (x+2) H2O (l) = TiO2·xH2O(s) + 4 HCl (g) Ti2+ 不存在(易氧化), TiCl2、TiBr2晶体存在, Ti4+不存在(水解)。 (2) 四氯化钛TiCl4