
3.紫外-可见吸收光谱的产生 由于分子吸收紫外-可见光区的电磁辐射,分子中 价电子(或外层电子)在不同的分子轨道之间(能 级)跃迁而产生。 电子能级的能量差△E。假如是5eV,可计算出: λ=hc/△E =6.624×10-34×2.998×108/5×1.6×10-19 =2.48×10-7m=248nm
3.紫外-可见吸收光谱的产生 由于分子吸收紫外-可见光区的电磁辐射,分子中 价电子(或外层电子)在不同的分子轨道之间(能 级)跃迁而产生。 电子能级的能量差 ΔEe 假如是5eV,可计算出: λ= hc/ΔE = 6.624×10-34×2.998×108/5×1.6×10-19 = 2.48×10-7m=248nm

电子跃迁产生的吸收光谱在紫外一可见光区 (200-780nm),称紫外一可见光谱.紫外 可见光谱属于电子跃迁光谱。 电子能级间跃迁的同时总伴随有振动和转动 能级间的跃迁。即电子光谱中总包含振动能 级和转动能级间跃迁产生的若干谱线而呈现 宽谱带
电子跃迁产生的吸收光谱在紫外—可见光区 (200-780nm),称紫外—可见光谱.紫外- 可见光谱属于电子跃迁光谱。 电子能级间跃迁的同时总伴随有振动和转动 能级间的跃迁。即电子光谱中总包含振动能 级和转动能级间跃迁产生的若干谱线而呈现 宽谱带
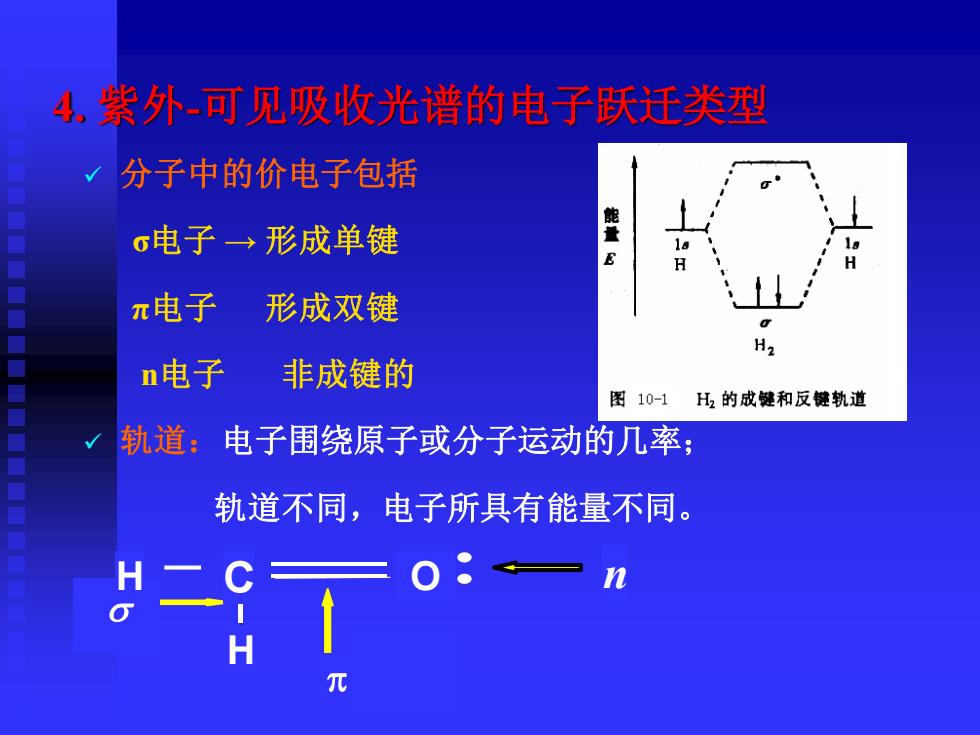
4.紫外可见吸收光谱的电子跃迁类型 分子中的价电子包括 能 σ电子→形成单键 E H π电子 形成双键 H2 n电子 非成键的 图10-1H2的成健和反键轨道 轨道;电子围绕原子或分子运动的几率; 轨道不同,电子所具有能量不同。 H二 —n H
4. 紫外-可见吸收光谱的电子跃迁类型 C O H n p s H ✓ 分子中的价电子包括 σ电子 → 形成单键 π电子 形成双键 n电子 非成键的 ✓ 轨道:电子围绕原子或分子运动的几率; 轨道不同,电子所具有能量不同
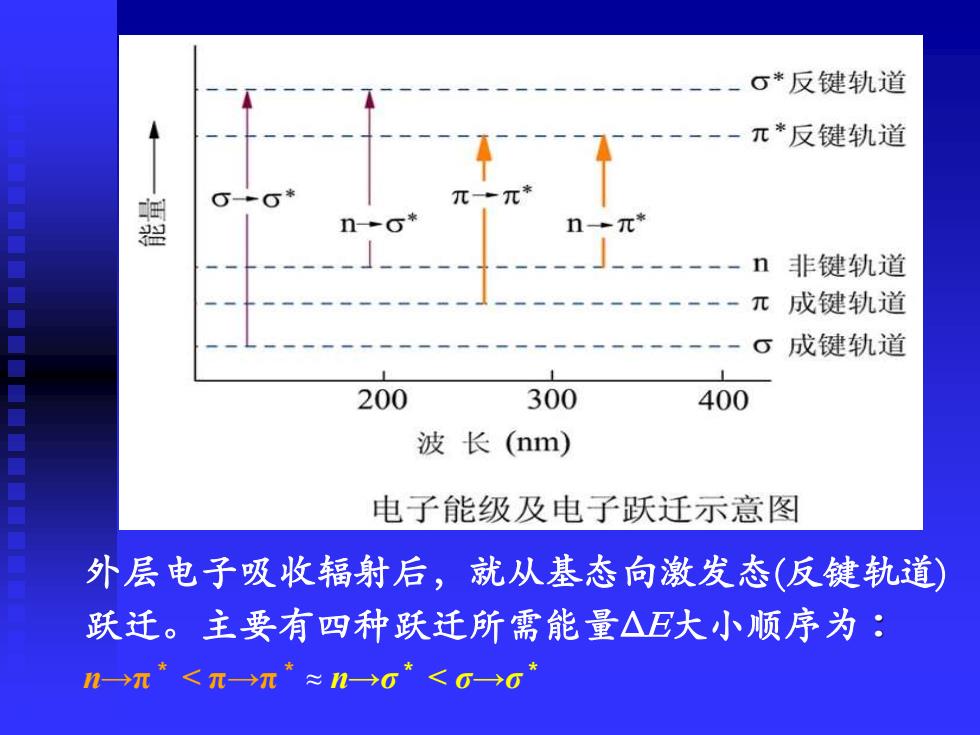
σ*反键轨道 π*反键轨道 盟 元 非键轨道 π成键轨道 成键轨道 200 300 400 波长(nm) 电子能级及电子跃迁示意图 外层电子吸收辐射后,就从基态向激发态(反键轨道) 跃迁。主要有四种跃迁所需能量△E大小顺序为: n→π≤π→π*≈n→g*≤G→6
外层电子吸收辐射后,就从基态向激发态(反键轨道) 跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为: n→π * < π→π* ≈ n→σ * < σ→σ *

>电子跃迁类型 1.6→6*跃迁 ◇所需能量最大,σ电子只有吸收远紫外 光的能量才能发生跃迁。 令饱和烷烃的分子吸收光谱出现在远紫外 区(吸收波长入<150nm,只能被真空紫外 分 光光度计检测到)。 如甲烷的为125nm 乙
1.σ→σ*跃迁 所需能量最大,σ电子只有吸收远紫外 光的能量才能发生跃迁。 饱和烷烃的分子吸收光谱出现在远紫外 区(吸收波长λ<150nm,只能被真空紫外 分 光光度计检测到)。如甲烷的λ为125nm, 乙 烷λmax为135nm。 ➢电子跃迁类型