
配体原子(主要因素) 配合物形成内外轨型取决于 中心离子(次要因素) 若配位原子的电负性较大,如:F、O等,易形成外轨型配合物: 若配位原子的电负性较小,如:C等,易形成内轨型配合物: >N、CI等配位原子的电负性居中,两种情况皆有可能: >中心离子电子构性为d8-10,易形成外轨型
配合物形成内外轨型取决于 配体原子(主要因素) 中心离子(次要因素) ➢若配位原子的电负性较大,如:F、O等,易形成外轨型配合物; ➢若配位原子的电负性较小,如:C等,易形成内轨型配合物; ➢N、Cl等配位原子的电负性居中,两种情况皆有可能; ➢中心离子电子构性为d 8~10,易形成外轨型

9.3配位平衡衡 一、不稳定常数与稳定常数 Cu(NH3)42+=C2++4NH3 人s- [CuNH)42+] C2++4NH3≥Cu(NH3)42 K [C(NH)42+] [C2+][NH,]H 所以 K不稳
9.3 配位平衡 一、不稳定常数与稳定常数 1 所以 K不稳= ———— K稳 2 2 3 4 3 Cu NH Cu NH ( ) 4 + + + 2 4 3 2 3 4 [ ][ ] K [ ( ) ] Cu NH Cu NH + + 不稳 = 2 3 4 2 4 3 [ ( ) ] K [ ][ ] Cu NH Cu NH + + 稳 = 2 2 3 3 4 Cu NH Cu NH 4 ( ) + + +
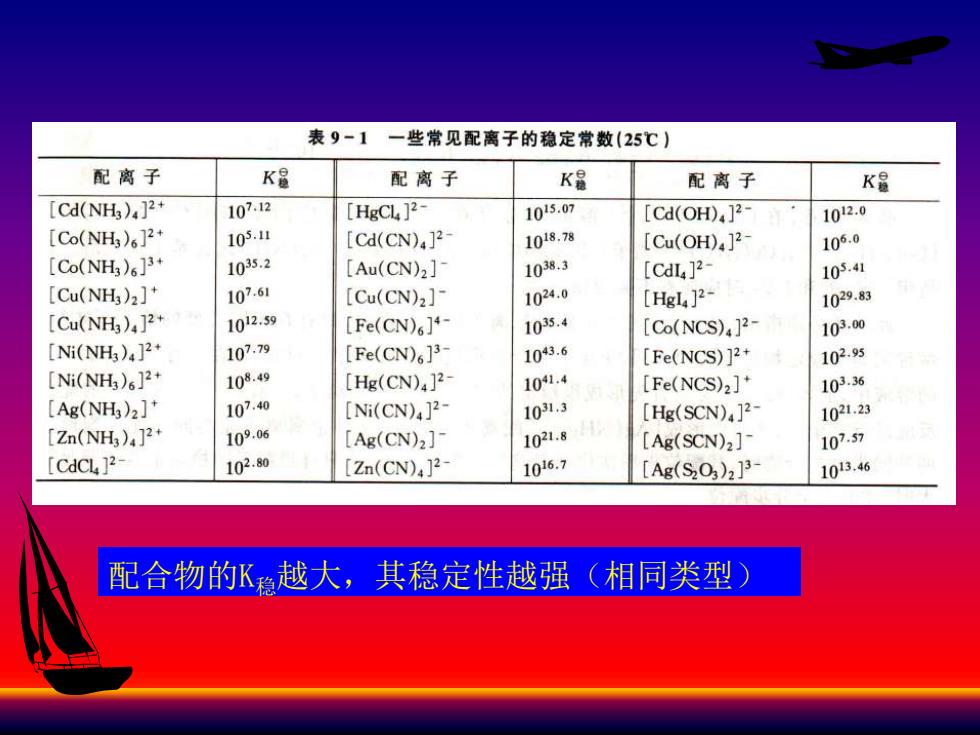
表9-1一些常见配离子的稳定常数(25℃) 配离子 K量 配离子 K鼠 配离子 K品 [Cd(NH)]2 107.12 [HgCL ]2- 1015.07 [Cd(oH).]2 1012.0 [Co(NH)6]2 105.1 [Cd(CN)4]2- 1018.78 [Cu(OH)4]2 105,0 [Co(NH)6]3 1035.2 [Au(CN)2]- 10383 [CdI]2- 105.41 [Cu(NH)2]* 107.61 [Cu(CN)2]- 1024.0 [Hgl4]2- 1029.83 [Cu(NH),]2 1012.59 [Fe(CN)6]4- 1035.4 [Co(NCS).]2- 103.00 [Ni(NH)4]2 107.9 [Fe(CN)6]3 1043.6 [Fe(NCS)]2+ 102,5 [Ni(NH)6]2+ 108.49 [Hg(CN)4]2 101.4 [Fe(NCS)2]* 103.36 [Ag(NH)2]* 107.40 [Ni(CN)4]2- 103,3 [Hg(SCN)]2- 1021.23 [Zn(NH3)4]2+ 109.06 [Ag(CN)2]- 1021.8 [Ag(SCN)2]- 107.57 [CdCL ]2- 102.80 Zn(CN)]2- 1016.7 [Ag(S203)2]3 1013,46 配合物的K稳越大,其稳定性越强(相同类型)
配合物的K稳越大,其稳定性越强(相同类型)

K1小K2、称为逐级 二、逐级稳定常数 稳定常数 Cu2++NIH3±Cu(NH)2 [Cu(NH3)2+] K 第一级稳 [Cu2+]X [NH 定常数 Cu (NH)2++NH3Cu (NH3)22*K2= [Cu(NH)22+] 第二级稳 [Cu(NI3)2+][NH3] 定常数 Cu (NH3)22*+NH3 Cu (NH3)32*K3= [Gu(NH3)32+ [Cu (NH )2*][NH3] Cu (NHa)32++NH3 Cu (NH3)2*K= [CuNH)42+] [Cu(NH)32+][NH3] Cu2++4NH3 Cu (NH)2 K稳=KK2·KgK4 由此可以得出 gK=1gK+1gK2+1gK3+1gK
Cu2++NH3 Cu(NH3) 2+ K1 =—————————— [Cu(NH3) 2+] [Cu2+]×[NH3] Cu(NH3) 2++NH3 Cu(NH3)2 2+ K2 =———————————— [Cu(NH3)2 2+] [Cu(NH3) 2+][NH3] 多配位数配合物的生成是 分步进行的,如: Cu(NH3)2 2++NH3 Cu(NH3)3 2+ K3 =———————————— [Cu(NH3)3 2+] [Cu(NH3)2 2+][NH3] Cu(NH3)3 2++NH3 Cu(NH3)4 2+ K4 =———————————— [Cu(NH3)4 2+] [Cu(NH3)3 2+][NH3] K稳=K1·K2·K3·K4 由此可以得出 lgK稳=lgK1+lgK2+lgK3+lgK4 第一级稳 定常数 第二级稳 定常数 K1、K2、.称为逐级 稳定常数 Cu2++4NH3 Cu(NH3)4 2+ 二、逐级稳定常数

1、计算溶液中的离子浓度 稳定常数的应用 2、配离子与沉淀之间的转化 3、配合物之间的转化 4、计算配离子的电极电势
1、计算溶液中的离子浓度 2、配离子与沉淀之间的转化 三、稳定常数的应用 3、配合物之间的转化 4、计算配离子的电极电势