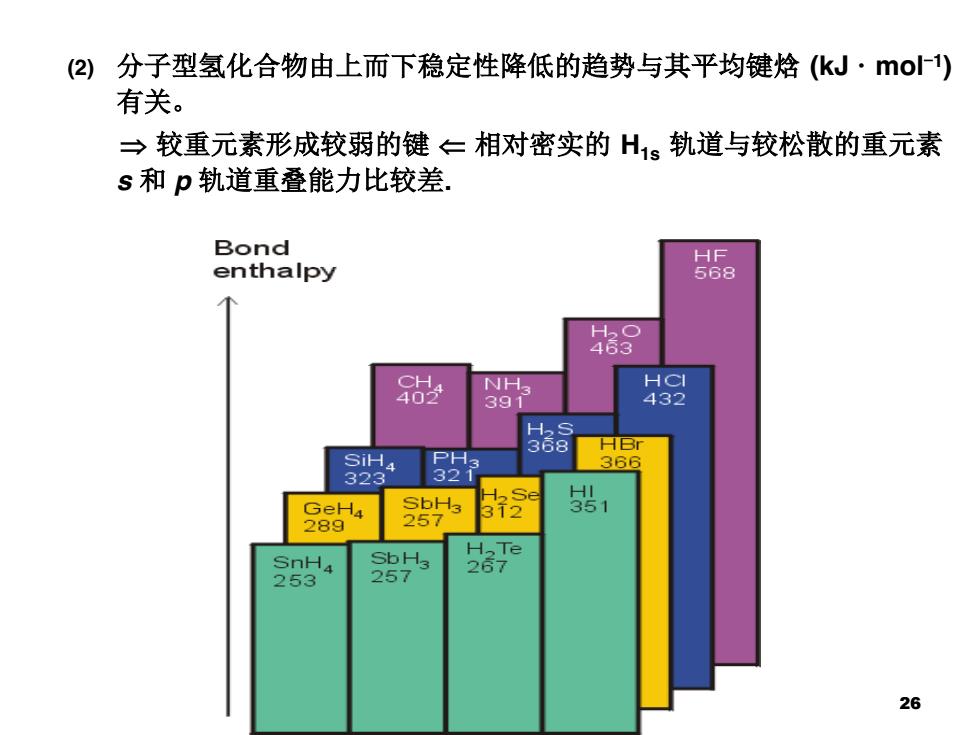
(2)分子型氢化合物由上而下稳定性降低的趋势与其平均键焓(k」·o) 有关。 →较重元素形成较弱的键←相对密实的H1s轨道与较松散的重元素 s和p轨道重叠能力比较差. Bond enthalpy HF 568 68 NH3 H⊙ 391 432 368 SiH PH3 3回 323 321 H2Se GeH4 SbH3 312 1 289 257 SnH4 SbH3 H,Te 267 253 257 26
(2) 分子型氢化合物由上而下稳定性降低的趋势与其平均键焓 (kJ · mol-1) 有关。 较重元素形成较弱的键 相对密实的 H1s 轨道与较松散的重元素 s 和 p 轨道重叠能力比较差. 26

3、离子型氢化物(MH): 碱金属(Li,Na,K,Rb,Cs)、碱土金属(Ca,Sr,Ba,Ra)+H (1)电正性高的s区金属离子型氢化物是非挥发性,不导电并具明确结构 的晶形固体。例如MH均为NaC1型。 (2)H的半径在126pm(亿iHD)与154pm(CsH)之间,如此大的变化幅度 说明原子核对核外电子的控制较松弛。H与X所带电荷相同,半径 (134-154pm)介于F(133pm)与C1(181pm)之间。因此才显示 出NaCl型。 (3)HⅢ存在的重要化学证据:电解其与碱金属的熔融物,阳极放H2: 2H→H2+2e (4)与水反应的实质是 H+H20→0H+H2↑ CaH2+2H20→Ca(0H)2+2H2↑ 此时什表现出强还原性、不稳定性和强碱性! 27
3、离子型氢化物(M+H-): 碱金属(Li, Na, K, Rb, Cs )、碱土金属(Ca, Sr, Ba, Ra) + H (1) 电正性高的 s 区金属离子型氢化物是非挥发性,不导电并具明确结构 的晶形固体。例如 MH 均为 NaCl 型。 (2) H-的半径在 126pm (LiH) 与 154pm(CsH)之间,如此大的变化幅度 说明原子核对核外电子的控制较松弛。H- 与 X- 所带电荷相同,半径 (134-154 pm)介于 F-(133 pm)与 Cl- (181 pm)之间。 因此才显示 出 NaCl 型。 (3) H-存在的重要化学证据:电解其与碱金属的熔融物,阳极放H2: 2 H- o H2 + 2e- (4) 与水反应的实质是 H- +H2O o OH- + H2 ↑ CaH2 + 2H2O → Ca(OH)2 + 2H2↑ 此时 H- 表现出强还原性、不稳定性和强碱性! 27

4、金属型氢化物: 第3至第5副族所有d区金属和f区金属都形成金属型氢化物: 3 4 5 6 8 9 10 11 12 Sc Cr Mn Fe Co Ni Cu Zn Known MH MH2 Unknown Nb Mo Ru Rh Pd Ag Cd M MH2 MH3 Hf Re Hg MH MH2 MH3 Pm Sm Gd Ho Er Tm Yb MH2 MH3 Ac Th Pa U Am Cm Bk Cf Es Fm Md No MH2 MH3 Th Hi5 NPaHis 28
第3至第5副族所有d 区金属和 f 区金属都形成金属型氢化物: 4、金属型氢化物: 28
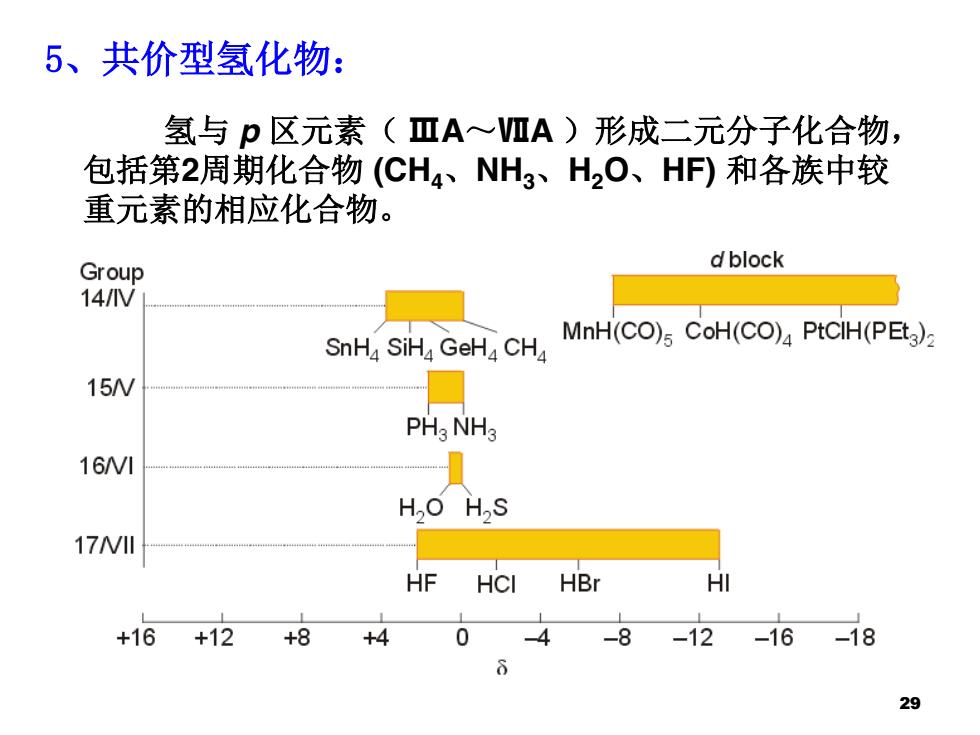
5、共价型氢化物: 氢与p区元素(ⅢA~VIA)形成二元分子化合物, 包括第2周期化合物(CH4、NH3、H2O、HF)和各族中较 重元素的相应化合物。 Group d block 14/V SnHa SiHa GeHa CHa MnH(CO)s CoH(CO)4 PtCIH(PEt )z 15W PHgNHg 16/VI H,O H2S 17W1川 44444 HF HCI HBr HI +16+12+8 +4 0 -4 -8-12 -16-18 29
氢与 p 区元素( ⅢA~ⅦA )形成二元分子化合物, 包括第2周期化合物 (CH4、NH3、H2O、HF) 和各族中较 重元素的相应化合物。 5、共价型氢化物: 29

5、共价型氢化物: (1)存在形式: ●缺电子氢化物,如B,H中 心原子B未满8电子构型. B2H6 ●满电子氢化物,如CH4, 中心原子价电子全部参与 CHg 成键 ●富电子氢化物,如NH2,中 心原子成键后有剩余未成键 NH3 的孤电子对. (2) 熔沸点低,通常条件下为气体; (③)因共价键极性差别较大而化学行为复杂。 30
(1) 存在形式: (2) 熔沸点低,通常条件下为气体; (3) 因共价键极性差别较大而化学行为复杂。 ● 缺电子氢化物,如 B2H6中 心原子B未满8电子构型. B2H6 ● 满电子氢化物,如 CH4, 中心原子价电子全部参与 成键. CH4 ● 富电子氢化物,如NH3,中 心原子成键后有剩余未成键 的孤电子对. NH3 5、共价型氢化物: 30