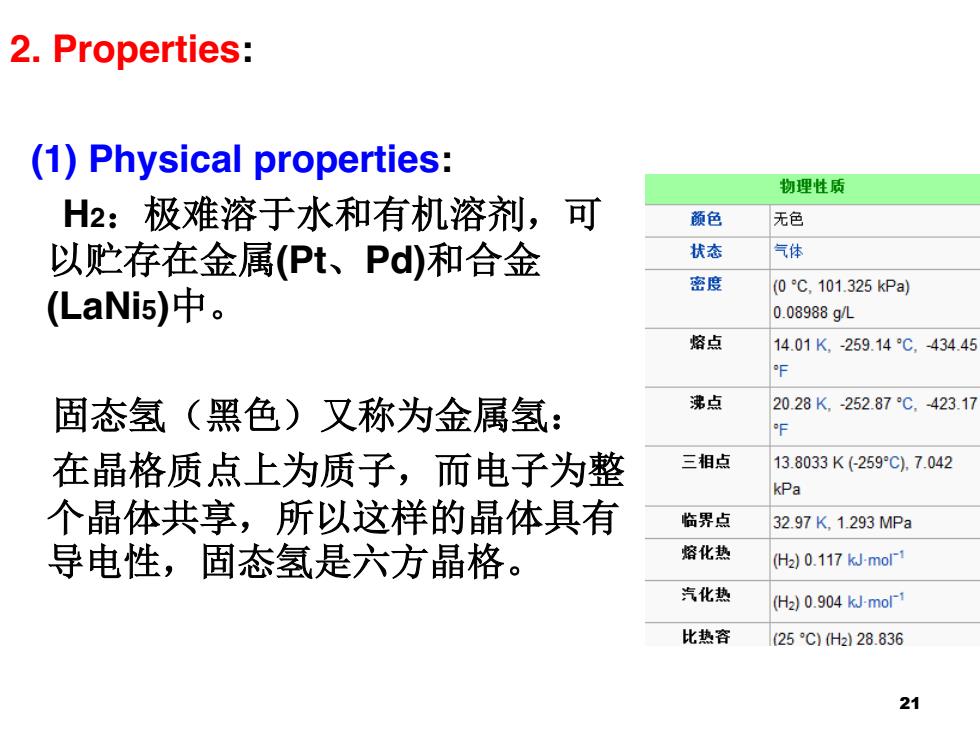
2.Properties: (1)Physical properties: 物理性质 H2:极难溶于水和有机溶剂,可 颜色 无色 以贮存在金属(Pt、Pd)和合金 状态 气体 密度 (0℃,101.325kPa) (LaNi5)中。 0.08988gL 熔点 14.01K,-259.14℃,434.45 固态氢(黑色)又称为金属氢: 沸点 2028K,252.87℃,423.17 在晶格质点上为质子,而电子为整 三相点 13.8033K(259°C)7.042 kPa 个晶体共享,所以这样的晶体具有 临界点 32.97K.1293MPa 导电性,固态氢是六方晶格。 容化热 (H2)0.117 kJ-mol-1 汽化热 (H2)0.904 kJ-mol-1 比热容 (25℃)(H228.836 21
2. Properties: (1) Physical properties: H2:极难溶于水和有机溶剂,可 以贮存在金属(Pt、Pd)和合金 (LaNi5)中。 固态氢(黑色)又称为金属氢: 在晶格质点上为质子,而电子为整 个晶体共享,所以这样的晶体具有 导电性,固态氢是六方晶格。 21

(2)Chemical properties: a.成键特点:电子构型为1s1,即可以放在IA族, 但第一电离势高于碱金属的第一电离势;也可放在 IA族。 b.化合反应:与金属:2Na+H2=2NaH Ca H2=CaH2 与非金属:H2+F2=2HF c.还原反应: CuO+H2=Cu H20 WO3+3H2=W+3H20 22
(2) Chemical properties: a. 成键特点:电子构型为 1s1 ,即可以放在IA族, 但第一电离势高于碱金属的第一电离势;也可放在 ⅦA族。 b. 化合反应:与金属: 2Na + H2 = 2NaH Ca + H2 = CaH2 与非金属: H2 + F2 = 2HF c. 还原反应: CuO + H2 = Cu + H2O WO3 + 3H2 = W + 3H2O 22

§11-1-2氢化物(Hydrides) >离子型氢化物(ionic or salt-like hydrides) ◆氢原子得到1个电子成H >金属型或过渡性氢化物(metallic or transition hydrides) >共价型氢化物(covalent hydrides) ◆氢原子与其它电负性不大的非金属原子通过共价键结合 18W川 12 13l 14V 15 16M 17MVI He 2Li Be Ne 3NaMg345678910112AlSi Ar 4K Ca Sr Ti V Cr Mn Fe Co Ni CuZn GaGe sSe Br Kr s Rb Sr Y Zr NbMo Tc Ru Rh Pd Ag Cd In Sn Sb Te1 Xe s Cs Ba Lu Hf Ta WReOs Ir Pt Au Hg TPb Bi Po At Rn ☐Saline ☐Metallic ☐Intermediate Molecular ☐Unknown 23
§11-1-2 氢化物(Hydrides) ¾ 离子型氢化物 (ionic or salt-like hydrides) ¾ 金属型或过渡性氢化物(metallic or transition hydrides) ¾ 共价型氢化物(covalent hydrides) 氢原子得到1个电子成H- 氢原子与其它电负性不大的非金属原子通过共价键结合 23
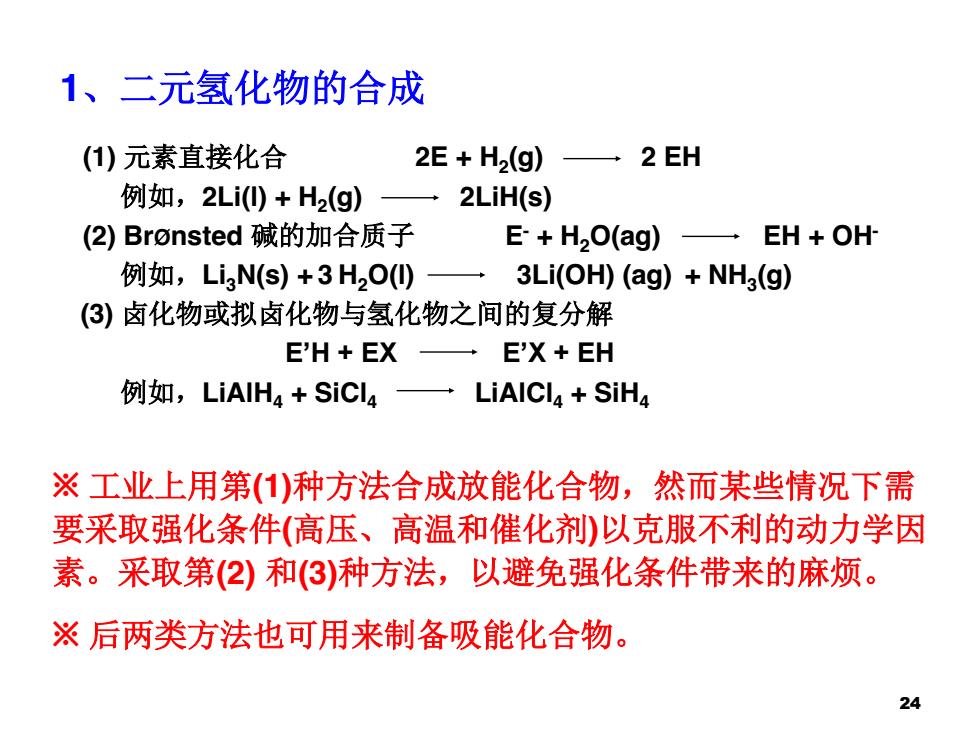
1、二元氢化物的合成 (1)元素直接化合 2E+H2(g) 一2EH 例如,2Li(0)+H2(g) 一2LiH(s) (2)Bronsted碱的加合质子 E+H2O(ag) EH OH 例如,L3Ns)+3H2O(0) 3Li(OH)(ag)+NH3(g) (3)卤化物或拟卤化物与氢化物之间的复分解 EH+EX一E'X+EH 例如,LiAIH4+SiC4一LiAICI4+SiH4 ※工业上用第(1)种方法合成放能化合物,然而某些情况下需 要采取强化条件(高压、高温和催化剂)以克服不利的动力学因 素。采取第(2)和(3)种方法,以避免强化条件带来的麻烦。 ※后两类方法也可用来制备吸能化合物。 24
1、二元氢化物的合成 (1) 元素直接化合 2E + H2(g) 2 EH 例如,2Li(l) + H2(g) 2LiH(s) (2) BrØnsted 碱的加合质子 E- + H2O(ag) EH + OH- 例如,Li3N(s) + 3 H2O(l) 3Li(OH) (ag) + NH3(g) (3) 卤化物或拟卤化物与氢化物之间的复分解 E’H + EX E’X + EH 例如,LiAlH4 + SiCl4 LiAlCl4 + SiH4 ※ 工业上用第(1)种方法合成放能化合物,然而某些情况下需 要采取强化条件(高压、高温和催化剂)以克服不利的动力学因 素。采取第(2) 和(3)种方法,以避免强化条件带来的麻烦。 ※ 后两类方法也可用来制备吸能化合物。 24

2、氢化物的热力学 (1) 二元氢化物的标准生成自由能△Gm是判断氢与其它元素直接化 合反应的重要判据,△G为正值的氢化物都不能由简单的反应合 成。 s区和p区元素二元氢化合物的△Pm/kJmo1(298K) 2 13 14 15 16 17 LiH(s) BeH2(s) B2He(g) CH,(g) NH3(g) H20(0 HF(g) -68.4 +20.0 +86.7 -50.7 -16.5 -237.1 -273.2 NaH(s) MgH2(s) AIHa(s) SiH(g) PH3(g) H2S(g) HCI(g) -33.5 35.9 -1.0 +56.9 +13.4 -33.6 -95.3 KH(s) CaH2(s) GaHg GeHa(g) AsH3(g) H2Se(g) HBr(g) -36.0 -147.2 >0 +113.4 +68.9 +15.9 -53.5 RbH(s) SrH2(s) SnH(g) SbH3(g) H2Te(g) HI(g) -30.0 -141.0 +188.3 +147.8 >0 +1.7 CsH(s) BaH2(s) -32.0 -140.0 25
(1) 二元氢化物的标准生成自由能 'GT m 是判断氢与其它元素直接化 合反应的重要判据, 'GT m为正值的氢化物都不能由简单的反应合 成。 s 区和 p 区元素二元氢化合物的 Δf Hθ m / kJ•mol–1 (298 K) 1 2 13 14 15 16 17 LiH(s) –68.4 NaH(s) –33.5 KH(s) –36.0 RbH(s) –30.0 CsH(s) –32.0 BeH2(s) +20.0 MgH2(s) –35.9 CaH2(s) –147.2 SrH2(s) –141.0 BaH2(s) –140.0 B2H6(g) +86.7 AlH3(s) –1.0 GaH3 >0 CH4(g) – 50.7 SiH4(g) +56.9 GeH4(g) +113.4 SnH4(g) +188.3 NH3(g) – 16.5 PH3(g) +13.4 AsH3(g) +68.9 SbH3(g) +147.8 H2O(l) – 237.1 H2S (g) – 33.6 H2Se (g) +15.9 H2Te (g) >0 HF(g) – 273.2 HCl (g) – 95.3 HBr(g) – 53.5 HI (g) +1.7 2、氢化物的热力学 25