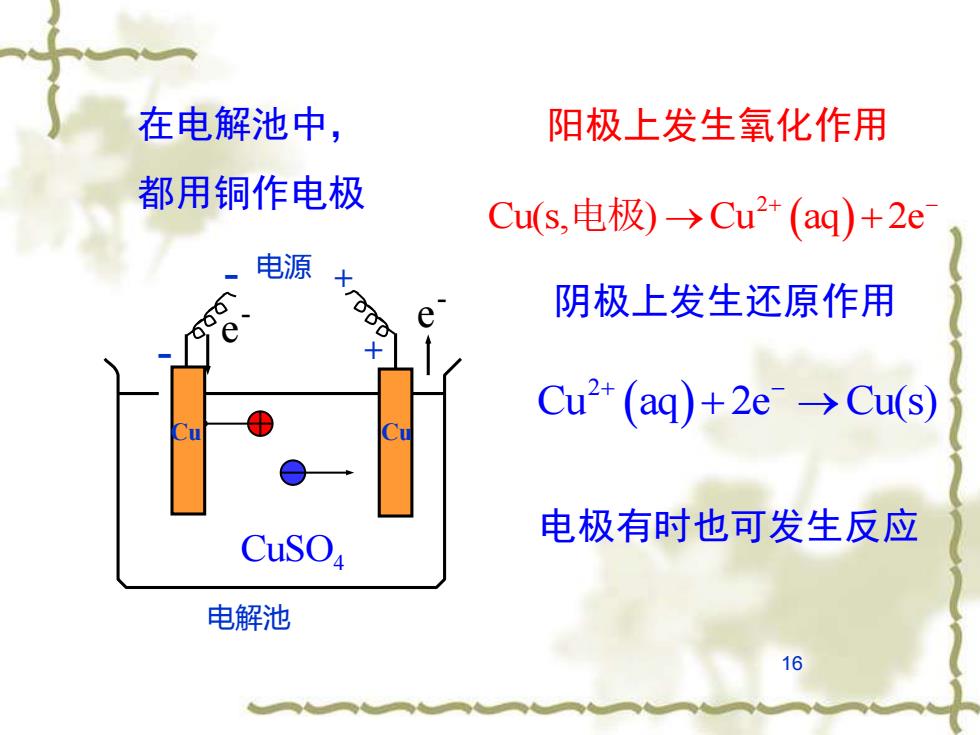
在电解池中, 阳极上发生氧化作用 都用铜作电极 Cu(s,电极)→Cu2+(aq)+2e 电源 e 阴极上发生还原作用 Cu2+(aq)+2e→Cu(s) 电极有时也可发生反应 CuSOa 电解池 16
16 阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 都用铜作电极 - 电源 + 电解池 + Cu - e - e - Cu CuSO4 ( ) 2 Cu aq 2e Cu(s) + − + → 电极有时也可发生反应 ( ) 2 Cu(s, ) Cu aq 2e 电极 → + + −

Faraday电解定律 Faraday归纳了多次实验结果,于1833年 总结出了电解定律 1.在电极界面上发生化学变化物质的质量 与通入的电荷量成正比。 2.通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比。 17
17 Faraday电解定律 Faraday 归纳了多次实验结果,于1833年 总结出了电解定律 ⒈ 在电极界面上发生化学变化物质的质量 与通入的电荷量成正比。 ⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比

人们把在数值上等于1mol元电荷的电量称为 Faraday常数。 已知元电荷电量e为1.6022×10-19C F=L.e =6.022×1023mol×1.6022×10-19 =96484.6C.mol-1 ≈96500C.mol- 18
18 人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。 已知元电荷电量 e 为 19 1.6022 10 C − F L e = 23 19 6.022 10 mol 1.602 2 10 C − = 1 96 484.6 C mol− = 1 96 500 C mol−

如果在电解池中发生如下反应: M-++ze->M(s) 电子得失的计量系数为z+,欲从阴极上沉积 出1molM(s),即反应进度为1mol时,需通入的电 量为Q Q(6=1)=zeL=2,F 若反应进度为ξ时需通入的电量为 Q(6)=2Fg 若通入任意电量Q时,阴极上沉积出金属B的物 质的量ne和质量mg分别为: 19
19 电子得失的计量系数为 z+,欲从阴极上沉积 出1 mol M(s),即反应进度为1 mol 时,需通入的电 量为 Q M e M(s) z z + − + + → Q z eL z F ( 1) + + = = = Q z F ( ) + = 如果在电解池中发生如下反应: 若通入任意电量Q时,阴极上沉积出金属B的物 质的量 nB 和质量 mB 分别为: 若反应进度为ξ时需通入的电量为

E.F 这就是Faraday电解定律的数学表达式 根据电学上的计量关系 I=do/dt Q-dr 若电流强度是稳定的的,则 Q=1.t 20
20 B + Q n z F = 0 d t Q I t = B B + Q m M z F = I Q t = d / d 根据电学上的计量关系 这就是Faraday电解定律的数学表达式 若电流强度是稳定的的,则 Q I t =