
§43酸碱溶液pH的计算 平衡关系 溶液pH的计算 1 强酸或强碱 物料平 2. 一元弱酸(弱 2. 电荷平衡 碱)溶液 3. 质子条件 3. 多元酸碱溶液 4. 两性物质溶液 5. 缓冲溶液 上一页下一页 返回退出
上一页 下一页 返回 退出 §4-3 酸碱溶液pH的计算 一.平衡关系 1. 物料平衡 2. 电荷平衡 3. 质子条件 二.溶液pH的计算 1. 强酸或强碱 2. 一元弱酸(弱 碱)溶液 3. 多元酸碱溶液 4. 两性物质溶液 5. 缓冲溶液 返回
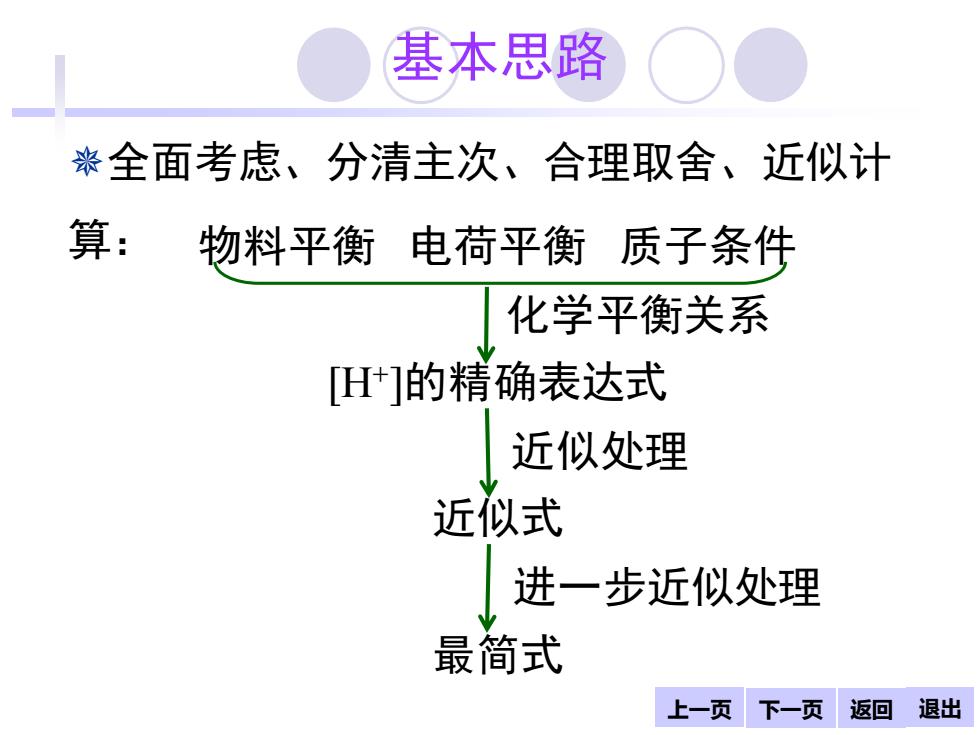
基本思路 染全面考虑、分清主次、合理取舍、近似计 算:物料平衡电荷平衡 质子条件 化学平衡衡关系 H]的精确表达式 近似处理 近似式 进一步近似处理 最简式 上一页 下一页 返回退出
上一页 下一页 返回 退出 基本思路 全面考虑、分清主次、合理取舍、近似计 算: 物料平衡 电荷平衡 质子条件 化学平衡关系 [H+ ]的精确表达式 近似处理 近似式 进一步近似处理 最简式 返回

平衡关系 1.物料平衡 (Material balance equation,MBE ©在一个化学平衡体系中,某一给定组分的总 浓度,等于各有关组分平衡浓度之和。 如浓度为c的下列物质溶液的MBE为 H3PO:[H3PO4]+H2PO]+HPO]+PO3-]=C Na2SO3: [Na+]=2C [S032]+HS03]+HzS03l=C 先分析溶液中可能存在的组分,根据平衡时存 在的各形式写出MBE,注意系数及浓度的单位 上一页下一页 返回退出
上一页 下一页 返回 退出 一、平衡关系 1. 物料平衡 (Material balance equation, MBE ) 在一个化学平衡体系中,某一给定组分的总 浓度,等于各有关组分平衡浓度之和。 如浓度为c的下列物质溶液的MBE为 H3PO4:[H3PO4 ] + [H2PO4 - ] + [HPO4 2- ] + [PO4 3- ] = C Na2SO3: [Na+ ] = 2C [SO3 2- ] + [HSO3 - ] + [H2SO3 ] = C 先分析溶液中可能存在的组分,根据平衡时存 在的各形式写出MBE,注意系数及浓度的单位 返回

2.电荷平衡 (Charge balance equation,CBE) ©根据电中性原则,溶液中阳离子所带正电 荷总数等于阴离子所带负电荷总数。 ©如浓度为c的下列物质溶液的CBE为 ●NaCN: [H+]+[Na][CN-]+[OH-] ●CaCl2: [H]+2[Ca2+]=[C]+[OH] 注意电荷数的相等。 上一页下一页返回退出
上一页 下一页 返回 退出 (Charge balance equation,CBE) 根据电中性原则,溶液中阳离子所带正电 荷总数等于阴离子所带负电荷总数。 如浓度为c的下列物质溶液的CBE为 ⚫NaCN: [H+ ] + [Na+ ] = [CN- ] + [OH- ] ⚫CaCl2: [H+ ] + 2[Ca2+] = [Cl- ] + [OH- ] 注意电荷数的相等。 2. 电荷平衡 返回

3.质子条件 (Proton balance equation,PBE) 酸碱反应达到平衡时,酸失去的质子数与 碱得到的质子数一定相等,即得质子后的 产物得到质子的物质的量必然与失去质子 后的产物失去质子的物质的量相等。 g写出PBE的途径: 根据得失质子的物质的量相等直接列出。 上一页下一页 返回退出
上一页 下一页 返回 退出 3. 质子条件 (Proton balance equation,PBE) 酸碱反应达到平衡时,酸失去的质子数与 碱得到的质子数一定相等,即得质子后的 产物得到质子的物质的量必然与失去质子 后的产物失去质子的物质的量相等。 写出PBE的途径: 根据得失质子的物质的量相等直接列出。 返回