
燃烧反应的热力学基础 1901 NG UNN 反应物与生成物的反应速度应符合该式所表达的计量关系: -dA]_-dIB]=dIc]=d(D]=r adt bdt cdt ddt 反应系统中各化合物的反应速度为: r4=-a TB=-br ic =cr ro=dr School of Energy and Power Engineering
燃烧反应的热力学基础 反应物与生成物的反应速度应符合该式所表达的计量关系: dA dB dC dD [] [] [] [] r adt bdt cdt ddt − − = === A ⎧r ar = − ⎪ 反应系统中各化合物的反应速度为: A B C r br r cr ⎪⎪ = − ⎨ = ⎪ C D ⎪⎩ r dr = School of Energy and Power Engineering

燃烧反应的热力学基础 、1901 VG UNN 质量作用定律 一一种化学组分消失的速率与参加反应的各化学组分浓度幂函数的乘 积成正比; 一幂函数的方次就是各自的化学计量系数。 瞬时反应速度为 当系统达到平衡时,正、反 正向反应速度:r=r,=k[A][B] 向反应速度相等 逆向反应速度:r=5=k,[C][D kr r=%=r→ [CFIDI=Ke 当反应系统中各种物质均服从 k,[A][B] 理想气体定律时 RT 01-2-R器 School of Energy and Power Engineering
燃烧反应的热力学基础 质量作用定律 —一种化学组分消失的速率与参加反应的各化学组分浓度幂函数的乘 积成正比; —幂函数的方次就是各自的化学计量系数。 [ ][ ] a b f f r r kA B = = G 当系统达到平衡时,正、反 正向反应速度: 向反应速度相等 幂函数的方次就是各自的化学计量系数。 瞬时反应速度为 [ ][ ] c d b b r r kC D = = H [ ][ ] [ ][ ] c d f f b a b b k C D r r r Kc k AB = =⇒ = = 逆向反应速度: 当反应系统中各种物质均服从 [ ][ ] b 理想气体定律时 [ ] [ ] A A BB np np A B V RT V RT == == [ ] [ ] C C D D n p n p C D V RT V RT == == School of Energy and Power Engineering

燃烧反应的热力学基础 1901 G UNN 平衡常数Kc又可写成 K。=LP/(RT)FP/(RT)Y LPA/(RT)ILPB/(RT)] PapB △n=(c+d)-(a+b) 令 则Kc与Kn的关系为Kc=(RT)amK。 平衡常数为有限值,反应物A、B并不能全部地变成生成物C、D。 平衡常数的值越大,正向反应进行得越完全,系统平衡时残留的反应物越 少。 School of Energy and Power Engineering
燃烧反应的热力学基础 平衡常数KC又可写成 [ / ( )] [ / ( )] 1 ( ) [ / ( )] [ / ( )] c d cd C D CD n C a b ab p RT p RT p p K p RT p RT RT p p Δ = = [ / ( )] [ / ( )] ( )( ) A B AB p RT p RT RT p p Δ= + − + n cd ab c d cd pp xx C D CD Δn p a b ab A B AB pp xx K p pp xx Δ 令 = = Δ 平衡常数为有限值 反应物A B并不能全部地变成生成物C D ( ) n K RT K C p −Δ 则KC与Kp的关系为 = 平衡常数为有限值,反应物A、B并不能全部地变成生成物C、D。 平衡常数的值越大,正向反应进行得越完全,系统平衡时残留的反应物越 少。 School of Energy and Power Engineering
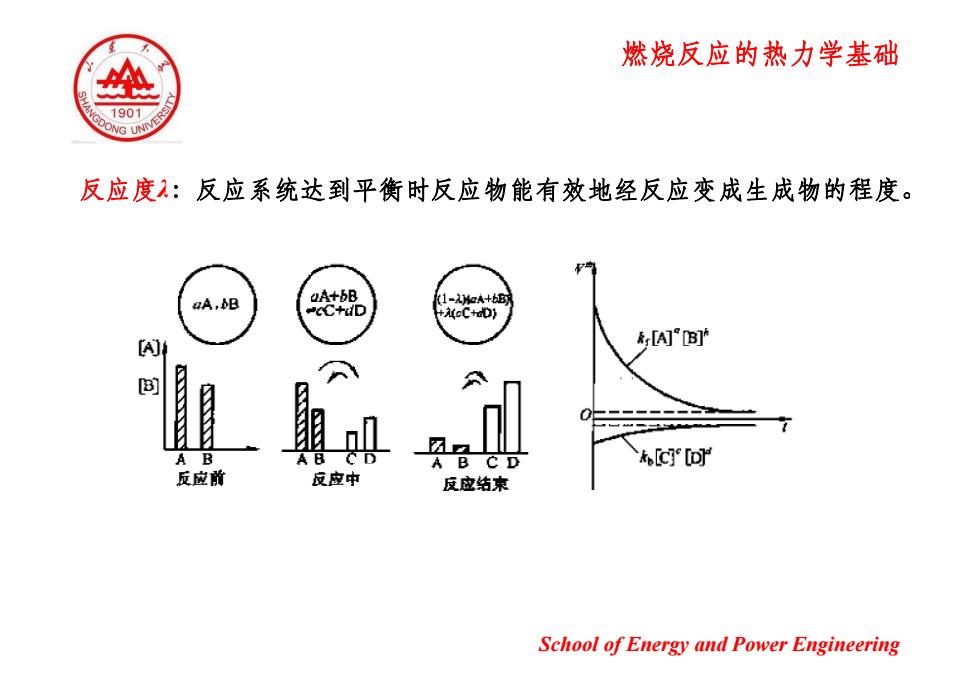
燃烧反应的热力学基础 1901 G UNN 反应度:反应系统达到平衡时反应物能有效地经反应变成生成物的程度。 aA.B (1-AH2A+6B A(cC+dD) A內B A B AB C D c回 反应前 反应中 反应结束 School of Energy and Power Engineering
燃烧反应的热力学基础 反应度λ:反应系统达到平衡时反应物能有效地经反应变成生成物的程度。 School of Energy and Power Engineering

燃烧反应的热力学基础 1901 (2)化学平衡与自由焓 在化学热力学中,单位质量物质的自由焓定义为 g=h-Ts g又称Gibbs自由烙,为状态参数。 对于一个反应过程的非孤立系统,判断过程体系是否平衡时用系统(反应 过程)自由焓的变化△G=0来判断。 表4-2 不同反应过程的G与△S的对应关系 反应过程 孤立系统 非弧立的反应过程 平衡 △S=0 △G=0 可逆过程 △$<0 G>0 不可逆过程 AS0 G<0 标准反应自由焓: AG2s=∑nAga,Ag7as School of Energy and Power Engineering
燃烧反应的热力学基础 (2)化学平衡与自由焓 在 学热力学中 在化学热力学中,单位 物 的自由焓定 为 单位质量物质的自由焓定义为 g又称Gibbs自由焓,为状态参数。 g = h Ts − g又称Gibbs自由焓,为状态参数。 对于一个反应过程的非孤立系统,判断过程体系是否平衡时用系统(反应 过程)自由焓的变化ΔG=0来判断。 标准反应自由焓: 00 0 Δ =Δ −Δ G ng n g R298 98, 98, ∑ ∑ i fi j f j 298, 298, ip jr = = School of Energy and Power Engineering