
第十五章:碳族元素 碳族元素 碳、陆属于同一,有 妻中处千对 位置,也有 是有机世 的能力最强。 (石头)中为】 机世界的主角, 二氧化 贝采利乌斯,小. 碳、硅、的通性 碳、硅、丽的氧化态 电子构型常见氧化态 [HeRs22p 2-40+24 4+24 [Hep2s22p' 业a 碳、硅、硼的通性 硅的 碳 介电子构 碳的杂化与戒特每 轨道 它是缺电子 子 同素异性体 等电子体原理 的 氧 化 能所 碳酸和碳酸盐 碳的硫化物和卤化物 碳的杂化与特性 sp) 量原于形成6个化季使 有此 的量 ,而且能与其它元
1 第十五章:碳族元素 碳 硅 硼 碳族元素通性 碳 锗分族 无机化合物的水解性 作业 本章要求 硅 碳硅硼化物 碳、硅属于同一族,有相似性。而硼和硅在周期 表中处于对角线位置,也有相似性,所以本章将它们 放在一起讨论。 碳(Carbon) 是有机世界的主角,由于碳自相成 链的能力最强,因此碳的化合物是最多的。 硅(Silicon) 贝采利乌斯1823年发现,拉丁文 (石头)中译为“矽”,因与锡同音,改为“硅”。硅是 无机世界的主角,二氧化硅是构成地壳的主要成分。 碳族元素的通性 碳、硅、硼的通性 碳 硅 硼 原 子 共 价 半 径 /p m 7 7 11 7 8 8 熔 点 /K 3 8 2 3 1 6 8 3 2 5 7 3 第 一 电 离 势 /(k J · m o l 1 ) 1 0 8 6 7 8 6 .1 7 9 2 .4 单 健 离 解 能 /(k J · m o l 1 ) 3 4 5 .6 2 2 2 2 9 3 2 1 X O 离 解 能 /(k J · m o l 1 ) 3 5 7 .7 4 5 2 5 6 1 6 9 0 X H 离 解 能 /(k J · m o l 1 ) 4 11 7 3 1 8 3 8 9 X F 离 解 能 /(k J · m o l 1 ) 4 8 5 5 6 5 6 1 3 5 3 电 负 性 ( 鲍 林 ) 2 .5 5 1 .9 0 2 .0 4 碳、硅、硼三种元素晶体的熔点和沸点很高,除石 墨外硬度也大。 碳单键键能大,碳结合成链能力强;硅、硼的XO键能 大,属于亲氧元素,碳的氢化物与O 2燃烧得碳的氧化物,而 硅、硼的氢化物大部分遇水就可生成含氧化合物。 XH键能都较大,它们都有一系列的氢化物。 碳、硅、硼的一些性质 碳、硅、硼的通性 [He]2s 0,+3 22p B 1 [Ne]3s 4,0,+2,+4 23p 2 Si [He]2s 2,4,0,+2,+4 22p C 2 电子构型 常见氧化态 碳、硅、硼的氧化态 碳、硅、硼的通性 碳、硅的成键特征: 碳与硅的价电子构型为ns 2np 2 ,价电子数目与价 电子轨道数相等,它们被称为等电子原子。 硼的价电子构型为2s22p 1 ,价电子数少于价电子 轨道数,所以它是缺电子原子。 碳和硅可以用sp、sp 2和sp 3杂化轨道形成2到4个 s键。碳的原子半径小,还能形成pp-pp键,所以碳 能形成多重键(双键或叁键),硅的半径大,不易形成 pp-pp键,所以Si的sp和sp 2态不稳定,很难形成多重 键(双键或叁键)。 碳的杂化与成键特征 碳的硫化物和卤化物 同 素 异 性 体 等 电 子 体 原 理 氧 化 物 碳 酸 和 碳 酸 盐 碳 碳的杂化与特性 一、碳的杂化类型 sp 3 四面体 金刚石 CH 4 sp 2 平面三角形 石墨 CO 3 2 C 6H 6 sp 直线形 CO 2 CS 2 C 2H 2 二、碳的特性 碳在同族元素中,由于它的原子半径最小,电负 性最大,电离能也最高,又没有d轨道,所以它与本 族其它元素之间的差异较大(p区第二周期的元素都 有此特点)。这差异主要表现在: (1)它的最高配位数为4, (2)碳的成链能力最强; (3)不但碳原子间易形成多重键,而且能与其它元 素如氮、氧、硫和磷形成多重键。 后二点是碳化合物特别多的原因。 碳的杂化与特性 传统的价键理论将受到挑战 美国Geogia大学量子化学计算中心主任 Schaefer的最新计算结果表明,有可能存在呈八 面体的CLi 6分子,该分子的碳原子周围总共有10 个电子,用以与6个锂原子形成6个化学键

碳的国素异性休 碳的同素异性体 二、石题 金刚石的燃烧 磊器稀龈臀 ,岁0 石墨的品体结构。。 碳的同豪异性体 碳的同素异性体 球 和表层营W 68 5到 级(1m=10m 碳的同素异性体 等电子体原理 1999年中因十 管技之 不后经有许多碳管健宝的业是 __ 到 O 化都有一襄门镜。 边。a 边。 氧化物 等电子体原理 O○ S02P0上,0.等离子属AX型.总价电子敦为 见的是剂和 3,中心原子取p来化道。中心原子上所有能 1、 的价电子都参与杂化了,或者说所有的轨道都已用 ⑩⑨ 于形成0能,因此,分子凰已经不可能有中心原子参 两青的分 D 的ppΠ键。这些等电子体32)都是正四面体的,分子 里的置能是p能 C三0C
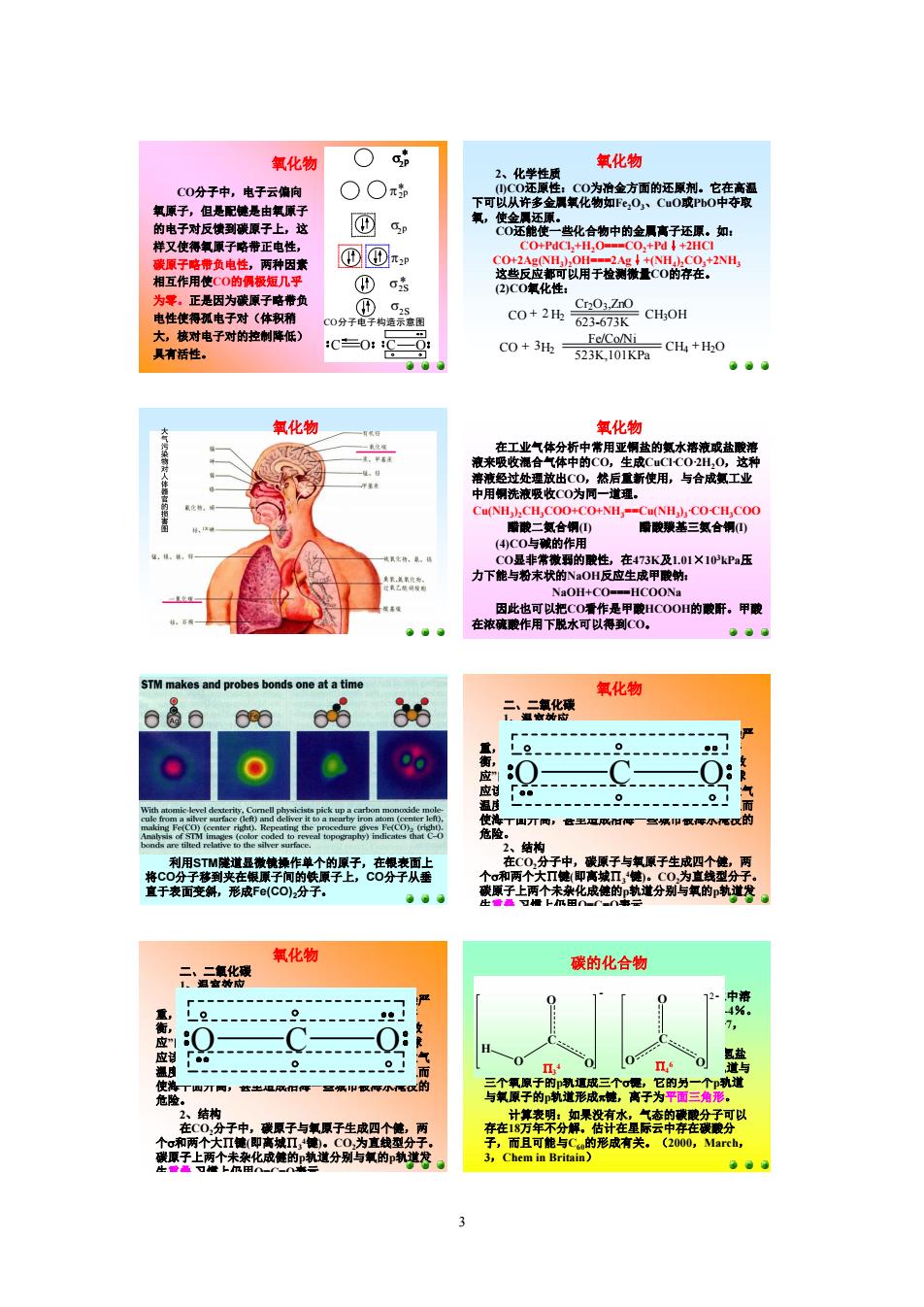
2 合成金刚石的新方法。 20世纪50年代高温高压石墨转化为金刚石。 一、金刚石 金刚石的外观是无色透明的固体,为原子晶体,每 个碳原了都以sp 3杂化轨道和其它四个原子形成共价键, 形成一种网状的巨形分于,再由于C一C键的键能相当高, 使得金刚石的硬度非常大,分子中没有自由电子,不导电; 在工业上可用于刀具来切割金属及制造高档装饰品。 碳的同素异性体 碳有金刚石和石墨C 60等同素异性体。无定形炭(如 木炭)本质上都是纯度不等的石墨微晶。 20世纪80年代微波炉中烃分解为金刚石。 20世纪90年代CCl 4+Na得到金刚石微晶。 碳的同素异性体 二、石墨 石墨分子结构是层形结构,每层是由无限个碳 六元环所形成的平面,其中的碳原子取sp2杂化,与 苯的结构类似,每个碳原子尚余一个未参与杂化的p 轨道,垂直于分子平面而相互平行。平行的n个p轨 道共n个电子在一起形成了弥散在整个层的n个碳原 子上下形成了一个pp大P键。 电子在这个大P键中可以自由移动,即石墨能 导电。在层与层之间是分子间作用力,因此层与层 之间就能滑动,石墨粉可以做润滑剂,再加上它的 颜色是黑色的,它又可做颜料和铅笔芯。 C 80球碳 C 60球碳可与氢发生加成反应。 碳的同素异性体 三、碳的新单质 1、C 60球碳: 1985年9月初美国Rice大学Smalley、Koroto 和Curl在氦气流里用激光气化石墨,发现了像足球 一样的碳分子—C 60,后来发现,它只是一个碳的一 大类新同素异形体——球碳C 60大家族里一员。 2、其它球碳 C 20球碳 C 24球碳 C 36球碳 C 80 管碳(碳纳米管): 1991年日本Sumio Iijima用电弧放电法制备C 60 得到的碳炱中发现管状的碳管碳的壁为类石墨二维 结构,基本上由六元并环构成,按管壁上的碳碳键 与管轴的几何关系可分为“扶手椅管”、“锯齿状管” 和“螺管”三大类,按管口是否封闭可分为“封口管” 和“开口管”,按管壁层数可分为单层管(SWNT) 和多层管(MWNT)。管碳的长度通常只达到纳米 级(1nm=10 9m)。 碳的同素异性体 1999年中国十大科技新闻之一 ——碳管储氢 1997年后曾经有许多碳管储氢的报道,但总是 令人不敢信。 直到1999年,我国沈阳金属研究所材料科学家 HuiMing Cheng等在权威性的杂志《Science》286 期第1127页上发表了一篇引起轰动的文章,称:在 室温、100个大气压下,他们在纳米碳管里储存了达 4.2%(质量)的氢气,碳氢原子比为2:1,在室温下将 压力降低到常压,80%的氢便释放出来,再稍微加 热,其余的氢也放了出来。该文的数据具体而翔实。 碳的同素异性体 等电子体原理 具有相同通式AXm,总价电子数又相等的分子或 离子往往具有相同的结构,这个原理称为“等电子体原 理”。 如:SCN ,NO 2+ ,N 3 具有相同的通式:AX 2,它们的 价电子总数都是16,因此它们的结构是相同的.即都具 有与CO 2相同的结构:直线型,中心原子取sp杂化轨道, 分子里有两套pp∏3 4键。 S C N CO 3 2 ,ClO 3 ,NO 3 ,SO3等分子或离子具有相同的通 式:AX 3 ,它们的总价电子数都等于24,因此它们有相同 的结构,即,它们是平面三角形分子,中心原子都取sp 2杂 化,都有一套∏4 6键。 O N O + ON C N N O 为什么不形成是一 套pp∏3 3键和一套 pp∏3 5键。而是两 套pp∏3 4键。 ¸ 等电子体原理 SO4 2 ,PO 4 3 ,ClO 4 等离子属AX 4型,总价电子数为 32,中心原子取sp 3杂化轨道。中心原子上所有p能级 的价电子都参与杂化了,或者说,所有的p轨道都已用 于形成σ键,因此,分子里已经不可能有中心原子参与 的pp∏键。这些等电子体(32e)都是正四面体的,分子 里的重键是dpπ键。 氧化物 碳有许多氧化物,已见报导的 有CO、CO 2、C 3O 2、C 4O 3、C 5O 2 和C 12O 9,其中常见的是CO和CO 2。 一、一氧化碳 1、结构 CO分子和N 2分子各有10个价 电子,它们是等电子体,两者的分 子轨道的能级次序形式相同: CO[KK(s2s ) 2(s2s *) 2(py2p ) 2(pz2p ) 2 (s2p ) 2],由一个s键,一个双电子p键和 一个电子来于O原子的p配键组成。 C O p s2s s2s* s2p 2*p s2p * 2p s* 2p * p2p CO分子电子构造示意图 C O
氧化钩 ○ 氧化物 0中,子云向 ○○a 氧原子,但是配是由氧原与 可以 样又使海子略带正电性 咨化合物中的金属高子还原。知: D①x 2C0氧化性: 为零 ,正是因为碳原子略带 c0+2h2-67 c0+352101Km :CH+H-O 氧化转 氧化物 的氯水 经过处放出( ,松后 新使用,与合工业 CH. Co+NH, 的作 01X10P压 力下能与粉末状的 STM and probes bonds one at a tim 氧化物 6 · 1。 氧原子生收四个, 原千两个化成德的 道分别与氧的航道 氧化物 碳的化合物 Le. 0 0●0
3 氧化物 CO分子中,电子云偏向 氧原子,但是配键是由氧原子 的电子对反馈到碳原子上,这 样又使得氧原子略带正电性, 碳原子略带负电性,两种因素 相互作用使CO的偶极短几乎 为零。正是因为碳原子略带负 电性使得孤电子对(体积稍 大,核对电子对的控制降低) 具有活性。 C O p s2s s2s * s2p 2*p s2p* 2p s* 2p* p2p CO分子电子构造示意图 C O 氧化物 2、化学性质 (l)CO还原性:CO为冶金方面的还原剂。它在高温 下可以从许多金属氧化物如Fe 2O 3、CuO或PbO中夺取 氧,使金属还原。 CO还能使一些化合物中的金属离子还原。如: CO+PdCl 2+H 2O===CO 2+Pd↓+2HCl CO+2Ag(NH 3) 2OH===2Ag↓+(NH 4) 2CO 3+2NH 3 这些反应都可以用于检测微量CO的存在。 (2)CO氧化性: + H + CO 2 + 523K,101KPa 623673K 3 2 Fe/Co/Ni Cr2O3,ZnO CH4 H2O CH H 3 OH CO 2 (3)CO的配合性:由于CO分子中有孤对电子, 可以作配体与一些有空轨道的金属原子或离子形成配 合物。例如同VIB、VIIB和VIII族的过渡金属形成羰 基配合物:Fe(CO)5、Ni(CO)4和Cr(CO) 6等(在过渡金 属中讲)。 CO有毒,它能与血液中携带O 2的血红蛋白(Hb) 形成稳定的配合物COHb。CO与Hb的亲和力约为O 2 与Hb的230—270倍。COHb配合物一旦形成后,就 使血红蛋白丧失了输送氧气的能力。所以CO中毒将 导致组织低氧症.如果血液中50%的血红蛋白与CO结 合,即可引起心肌坏死. 大气污染 物对人体器官的损 害图 氧化物 在工业气体分析中常用亚铜盐的氨水溶液或盐酸溶 液来吸收混合气体中的CO,生成CuCl·CO·2H 2O,这种 溶液经过处理放出CO,然后重新使用,与合成氨工业 中用铜洗液吸收CO为同一道理。 Cu(NH 3) 2CH 3COO+CO+NH 3==Cu(NH 3) 3·CO·CH 3COO 醋酸二氨合铜(I) 醋酸羰基三氨合铜(I) (4)CO与碱的作用 CO显非常微弱的酸性,在473K及1.01×10 3kPa压 力下能与粉末状的NaOH反应生成甲酸钠: NaOH+CO===HCOONa 因此也可以把CO看作是甲酸HCOOH的酸酐。甲酸 在浓硫酸作用下脱水可以得到CO。 氧化物 利用STM隧道显微镜操作单个的原子,在银表面上 将CO分子移到夹在银原子间的铁原子上,CO分子从垂 直于表面变斜,形成Fe(CO)2分子。 二、二氧化碳 1、温室效应 近几十年来由于世界工业高速发展,各类污染严 重,森林又滥遭砍伐,石油轮泻油,影响了生态平 衡,使大气中的CO 2越来越多,是造成地球“温室效 应”的主要原因。CO 2能吸收红外光,这就使得地球 应该失去的那部分能量被储存在大气层内,造成大气 温度升高。会使地球两极的冰山发生部分融化,从而 使海平面升高,甚至造成沿海一些城市被海水淹没的 危险。 2、结构 在CO 2分子中,碳原子与氧原子生成四个健,两 个s和两个大∏键(即离城∏3 4键)。CO 2为直线型分子。 碳原子上两个未杂化成健的p轨道分别与氧的p轨道发 生重叠,习惯上仍用O=C=O表示。 氧化物 O C O 二、二氧化碳 1、温室效应 近几十年来由于世界工业高速发展,各类污染严 重,森林又滥遭砍伐,石油轮泻油,影响了生态平 衡,使大气中的CO 2越来越多,是造成地球“温室效 应”的主要原因。CO 2能吸收红外光,这就使得地球 应该失去的那部分能量被储存在大气层内,造成大气 温度升高。会使地球两极的冰山发生部分融化,从而 使海平面升高,甚至造成沿海一些城市被海水淹没的 危险。 2、结构 在CO 2分子中,碳原子与氧原子生成四个健,两 个s和两个大∏键(即离城∏3 4键)。CO 2为直线型分子。 碳原子上两个未杂化成健的p轨道分别与氧的p轨道发 生重叠,习惯上仍用O=C=O表示。 氧化物 O C O 一、碳酸和碳酸盐 CO 2在水中的溶解度不大,298K时,1L水中溶 1.45g(约0.033mol)。CO 2转变成H 2CO 3的只有14%。 因为CO 2能溶于水,所以蒸馏水的PH值常小于7, 酸碱滴定时粉色的酚酞溶液在空气中能退色。 H 2CO 3是二元弱酸,能生成两种盐:碳酸氢盐 和碳酸盐。碳原子在这两种离子中均以sp 2化轨道与 三个氧原子的p轨道成三个s键,它的另一个p轨道 与氧原子的p轨道形成p键,离子为平面三角形。 碳的化合物 计算表明:如果没有水,气态的碳酸分子可以 存在18万年不分解。估计在星际云中存在碳酸分 子,而且可能与C 60的形成有关。(2000,March, 3,Chem in Britain) C O O O H C O O O 2 P4 6 P3 4

碳的化合物 碳的化合物 和 盐都港于水。正盐中只有映盐、蛇 难清的,对于这些盐 格得到碳盐 离子有的式 而降在了碳服的解度 能不 碳的化合物 碳的硫化物和卤化物 3、热赖定性: 一般情况如:CaCO,、ZC0,和PbCO加格即分 CCI.Chr.C. 解为金周氧化物和C0,而钠、佩、额的碳酸盐在离温 常下的状态气液国 下也不分解 颜色无无淡黄淡红 溶解性均不溶于水,只溶于有机溶剂 作用▣过一般金黑离子所以有下列热雅定性顺序 M.CO >MHCOPH.CO C0C1:叫光气有毒 硅 大部分要的岩石是由壁的化合 尊高态的硅 硅的杂化与成健特征 成的 硅 单 共 硅 烧 的大,且有3 卤化物和氯硅酸盐 1它的量本配位餐悬6。誉里配食费悬。 硅的含氧化合物 2)它不能形成 边。d 硅单质 及 天 子共价半径/m士 下 第电高的, 76.1 H,的气相反应
4 1、溶解性 所有碳酸氢盐都溶于水。正盐中只有铵盐、铊 盐和碱金属的盐溶于水。 其它金属的碳酸盐都是难溶的,对于这些盐来 说,它们的酸式盐要比正盐的溶解度来的大。 碱金属(除锂外)和NH 4+ 离子有固态的酸式 盐,它们在水中的溶解度比相应的正盐的溶解度小。 这同HCO 3 离子在它们的晶体中通过氢键结合成 链,而降低了碳酸氢盐的溶解度。 碳的化合物 C O O O H H O O O C C O O O H H O O O C 有些金属离子如Cu 2+ 、Zn 2+ 、Pb 2+ 和Mg 2+ 等,其 氢氧化物和碳酸盐的溶解度相差不多,则可能得到碱 式盐。 2Cu 2+ +2CO 3 2 +H 2O=Cu 2(OH)2CO 3↓+CO 2↑ 碳的化合物 2、水解性 在金属盐类(除碱金属和NH 4+ 及Tl盐)溶液中加可 溶性碳酸盐,产物可能是碳酸盐、碱式碳酸盐或氢氧 化物。究竟是哪种产物,取决于反应物、生成物的性 质和反应条件。如果金属离子不水解,将得到碳酸盐。 如果金属离子的水解性极强,其氢氧化物的溶度积又 小,如Al 3+ 、Cr 3+ 和Fe 3+ 等,将得到氢氧化物。 2Al3+ +3CO 3 2 +3H 2 O=2Al(OH) 3 ↓+3CO 2 ↑(此反应用于灭火器) 碳的化合物 3、热稳定性: 一般情况如:CaCO 3、ZnCO 3和PbCO 3加热即分 解为金属氧化物和CO 2,而钠、钾、钡的碳酸盐在高温 下也不分解。 碳酸盐受热分解的难易程度与阳离子的极化作用 有关。阳离子对CO 3 2 离子的极化作用,使CO 3 2 不稳定 以致分解,极化作用越大越易分解。H + (质子)的极化 作用超过一般金属离子,所以有下列热稳定性顺序: M 2CO 3>MHCO 3>H 2CO 3 碳的硫化物和卤化物 二、碳的硫化物和卤化物 1.二硫化碳 二硫化碳CS 2为无色有毒的挥发性液体,极易 着火: CS 2(l)+3O 2(g)==CO 2(g)+SO 2(g) 它不溶于水,可作为有机物、磷和硫的溶剂。 溶解2.碳的性 卤化物 均不溶于水,只溶于有机溶剂 颜色 无 无 淡黄 淡红 常温下的状态 气 液 固 固 CI CB 4 r CF4 CC1 4 4 金属 非极性分子,稳定,不分解,比重比水大。 CC1 4是常用的灭火剂,但不能扑灭金属。 H 2O+CCl 4===COCl 2+HCl COCl 2叫光气有毒! 硅的杂化与成键特征 硅 单 质 硅 烷 卤 化 物 和 氟 硅 酸 盐 硅 的 含 氧 化 合 物 硅 硅的杂化与成键特征 由于硅易与氧结合,自然界中没有游离态的硅。 大部分坚硬的岩石是由硅的含氧化合物构成的。 硅原子的价电子构型与碳原子的相似,它也可 形成sp 3、sp 2和sp等杂化轨道,并以形成共价化合 物为特征。不过它的原子半径比碳的大,且有3d轨 道,因而情况又与碳原子有所不同: (1)它的最高配位数是6,常见配位数是4。 (2)它不能形成pppp键,无多重键,而倾向于 以较多的s单键形成聚合体,例如通过Si-O-Si链 形成形形色色的SiO 2聚合体和硅酸盐。 硅有两种晶型。无定形硅为深灰色粉末,晶形硅为 银灰色,且具金属光泽,能导电,但导电率不及金 属,且随温度的升高而增加。硅在化学性质方面主要 表现为非金属性。象这类性质介于金属和非金属之间 的元素称为“准金属”或“类金属”或“半金属”。准金属 是制半导体的材料。 计算机芯片、太阳能电池是硅做的。自然界没有 单质硅。是化学家,把砂子(SiO 2)转化为硅(Si),形成 了计算机的基石。 SiO 2+C+2Cl 2====SiCl 4+CO 2 SiCl 4+2H 2====Si+4HCl 晶态硅具有金刚石那样的结构,所以它硬而脆 (硬度为7.0)、熔点高,在常温下化学性质不活泼。 太阳能汽车 宇航员试图展开 太阳能电池翅板。 硅单质 硅单质 无定形硅比晶态硅活泼。其主要化学性质如下: 1、与非金属作用 Si在常温下只能与F2反应,生成SiF4(Si—F键的键 能很大)。但在高温下能与其它卤素和一些非金属单质 反应,如与Cl 2反应,得到SiCl 4、与O 2反应生成SiO 2、 与N 2反应得到Si3N 4、与碳生成SiC。这些化合物均有 广泛用途,如Si3N 4陶瓷材料。它耐高温、高强度、耐 磨等,可用于发动机等。 合成Si3N 4的方法有三:(1)用硅和氮气直接反应;(2) 将SiO 2在氮气中用炭还原,然后进行氮化;(3)利用 SiCl 4和NH 3的气相反应。 键能 原子共价半径/pm 117 熔点/K 1683 第一电离势/(kJ·mol1) 786.1 单健离解能/(kJ·mol1) 222 SiO 离解能/(kJ·mol 1) 452 SiH 离解能/(kJ·mol 1) 318 SiF 离解能/(kJ·mol 1) 565 SiC 离解能/(kJ·mol 1) 318 电负性(鲍林) 1.90

硅单质 硅烷 2、与酸作用 氢化物,不过由于1) )它不能形成 的化物要少得多 购硅控的物理性盾 8HF=3H:F。+40↑+8H 无 碱作用 SiH.SiH SiH SiH 能与某签金属生成硅化物如:g,S。 密度(/em 硅烷 硅烷 3、热德定性 1,+2 +2息,0 所有硅烤的热建定性都根差。分于量大的定性 更差。将高础挑适当地如 ,它们即分解为低硅洗 低陆烧(如SH,)在温度高于73K即分解为单质陆和 复气, 作 S,教大地用于制高纯。的纯度越高,大 规横桌成电路的性能戴越好。 破的卤化物和刻 沸点都比较 用蒸慎的力 物的料 能电池用的 类、有机过 导纤维所需 SiF +2FSiF 的面化物率 的由化物和 2、制取 水解的1P,极局与水解产物正 硅的宝化物可以用下列方法制取 181 (1)硅与卤度直袋化合 (2)氧化物与氢酸成化物作用 9的 SiO.(sH+2CaF,(sH+2H,SOASiF(gH+2CaSo.(sH+2H.O() (3)晓氧法 2Na.CO:+2H,0+3SiF-+2NSiF +Hsio+2C0, g10.+2c+2c1.-481c1.+2c0 NaF SiF-NaSiFs
5 硅单质 2、与酸作用 Si在含氧酸中被钝化。Si与HF或有氧化剂(HNO 3、 CrO 3、KMnO 4、H 2O 2等)存在的条件下,与HF酸 反应。 Si+2HF===SiF4↑+H 2↑ SiF4+2HF===H 2SiF6(氟硅酸) 3Si+4HNO 3+18HF=3H 2SiF6+4NO↑+8H 2O 3、与碱作用 无定形Si能猛烈地与强碱反应,放出H 2。 Si+2NaOH+H 2O==Na 2SiO 3+2H 2↑ 4、与金属作用 Si能与某些金属生成硅化物如:Mg 2Si。 硅与碳相似,有一系列氢化物,不过由于(1)硅 自相结合成链的能力比碳差(2)它不能形成pppp 键,多重键(3)由于Si有d轨道,易受其它有孤对电 子的原子的进攻,所以稳定性要差得多。这样硅生成 的氢化物要少得多。 硅烷的通式为Si nH 2n+2(7≥n≥1)来表示,结构 与烷烃相似(一硅烷又称为甲硅烷)但化学性质比相应 的烷烃活泼。 由于硅不能与H 2 直接作用,简单的硅烷常用金属 硅化物与酸反应来制取。例如: Mg 2Si+4HCl=SiH4 ↑+2MgCl2 硅烷 硅烷 l、强还原性 能与O 2 或其它氧化剂猛烈反应。它们在空气中自 燃,燃烧时放出大量的热,产物为SiO2 。如: SiH 4+2O 2===SiO2+2H 2O 碱 燃烧 能与一般氧化剂反应。如: SiH 4+2KMnO 4===2MnO 2↓ +K2SiO 3+H2+H2O SiH 4+8AgNO3+2H 2O===8Ag↓+SiO2 ↓+8HNO3 这二个反应可用于检验硅烷。 2、与水作用 硅烷在纯水中不水解,但当水中有微量碱存在 时,由于减的催化作用,水解反应即激烈地进行。 SiH 4+(n+2)H 2O===SiO 2·nH 2O+4H 2↑ 硅烷 3、热稳定性 所有硅烷的热稳定性都很差。分子量大的稳定性 更差。将高硅烷适当地加热,它们即分解为低硅烷。 低硅烷(如SiH 4)在温度高于773K即分解为单质硅和 氢气。 SiH 4被大量地用于制高纯硅。硅的纯度越高,大 规模集成电路的性能就越好。 一、卤化物 硅的卤化物都是共价化合物,熔点、沸点都比较 低,氟化物、氯化物的挥发性更大,易于用蒸馏的方 法提纯它们,常被用作制备其它含硅化合物的原料。 例如质量百分比为99.99%的SiF4是制太阳能电池用的 非晶态硅的原料。SiCl 4主要用于制硅酸脂类、有机硅 单体、高温绝缘漆和硅橡胶,还用于制光导纤维所需 要的高纯度石英。 硅的卤化物和氟硅酸盐 1、卤化物水解 硅的卤化物强烈地水解,它们在潮湿空气中发 烟,如: SiCl 4(l)+3H 2O(l)===H 2SiO 3(l)+4HCl(aq) 故SiCl 4可作烟雾剂。但是CCl 4不水解。这与Si有 3d轨道,配位数为6(sp 3d 2杂化),能同H 2O配位, 而碳原子不具备此条件。 硅的卤化物和氟硅酸盐 由此,SiF4很容易与F 形成SiF6 2 配离子。 SiF4+2F ===SiF6 2 硅的卤化物和氟硅酸盐 2、制取 硅的卤化物可以用下列方法制取: (1)硅与卤素直接化合 (2)氧化物与氢卤酸或卤化物作用 SiO 2(s)+2CaF2(s)+2H 2SO 4==SiF4(g)+2CaSO 4(s)+2H 2O(l) (3)碳氯法 SiO2+2C+2Cl 2===SiCl4+2CO 硅的卤化物和氟硅酸盐 二、氟硅酸及其盐 当SiF 4 水解时,未水解的SiF 4 极易与水解产物HF 配位形成氟硅酸H 2SiF 6 SiF 4+2HF===H 2SiF 6 现在还未制得游离的H 2SiF 6 ,只能得到60%的溶 液。它是一种强度相当于H 2SO4 的强酸。金属锂、钙等 的氟硅酸盐溶于水;钠、钾、钡盐难溶于水。用纯碱溶 液吸收SiF 4 气体,可得到白色的氟硅酸钠Na2SiF6 晶体。 SiF 4 + + + SiF 4 Na2SiF 6 + + + NaF KF SiF 4 H 2O CO H 4S 2 iO 4 K 2SiF 6 Na2SiF 6 Na2CO 2 3 2 3 2 2