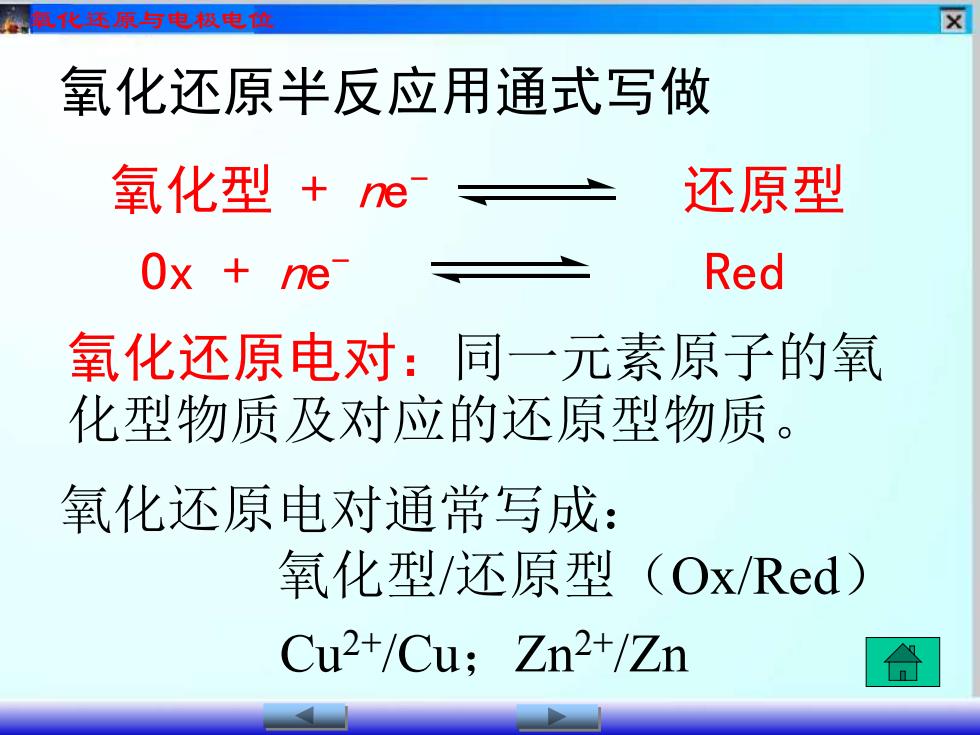
化还原与电风电 ☒ 氧化还原半反应用通式写做 氧化型+e 还原型 Ox ne Red 氧化还原电对:同一元素原子的氧 化型物质及对应的还原型物质。 氧化还原电对通常写成: 氧化型/还原型(Ox/Red〉 Cu2+/Cu;Zn2+/Zn
氧化还原与电极电位 氧化还原半反应用通式写做 氧化型 + ne - 还原型 Ox + ne - Red 氧化还原电对:同一元素原子的氧 化型物质及对应的还原型物质。 氧化还原电对通常写成: 氧化型/还原型(Ox/Red) Cu2+/Cu;Zn2+/Zn

化与电电 例: 2KMnOa+5H2O2+3H2SO=K2SO+2MnSO4+502+8H2O 还原反应: MnO,+8H++5e Mn2+4H,O 氧化反应: H202-2e=02+2H
氧化还原与电极电位 例: MnO4 - + 8H+ + 5e- Mn2+ + 4H2O 2KMnO4+5H2O2+3H2SO4= K2SO4+2MnSO4 +5O2+8H2O H2O2-2e = O2+2H+ 还原反应: 氧化反应:

化还原与电风电位 ☒ 三、氧化还原反应方程式的配平 离子一电子法配平氧化还原方程式 配平原则: (1)电荷守恒:得失电子数相 等。 (2)质量守恒:反应前后各元 素原子总数相等
氧化还原与电极电位 离子— 电子法配平氧化还原方程式 配平原则: (1) 电荷守恒:得失电子数相 等。 (2) 质量守恒:反应前后各元 素原子总数相等。 三、氧化还原反应方程式的配平

丸化克与电找电 ☒ 配平步骤: (1)用离子式写出主要反应物和产物(气 体、纯液体、固体和弱电解质则写分子式)。 (2)将反应分解为两个半反应式,并配平 两个半反应的原子数及电荷数。 (3)根据电荷守恒,以适当系数分别乘以 两个半反应式,然后合并,整理,即得配平的 离子方程式;有时根据需要可将其改为分子方 程式
氧化还原与电极电位 (1)用离子式写出主要反应物和产物(气 体、纯液 体、固体和弱电解质则写分子式)。 (2)将反应分解为两个半反应式,并配平 两个半反应的原子数及电荷数。 (3)根据电荷守恒,以适当系数分别乘以 两个半反应式,然后合并,整理,即得配平的 离子方程式;有时根据需要可将其改为分子方 程式。 配平步骤:

。丸化还原与电电位 ☒ 第二节】 原电池与电极电位 一、原电池及工作原理 (一)原电池的组成 把锌片置于CuSO溶液中,一段时间后可以 观察到CuSO,溶液的蓝色渐渐变浅,而锌片上会 沉积出一层棕红色的铜。这是一个自发进行的氧 化还原反应。 Zn+CuS0=Cu+ZnS04△,Gm°=-212.6 kJ-mol-
氧化还原与电极电位 (一)原电池的组成 把锌片置于CuSO4溶液中,一段时间后可以 观察到CuSO4溶液的蓝色渐渐变浅,而锌片上会 沉积出一层棕红色的铜。这是一个自发进行的氧 化还原反应。 Zn+ CuSO4 Cu + ZnSO4 = -212.6 kJ·mol-1 θ r Gm 一、原电池及工作原理 第二节 原电池与电极电位