
正电子在材料科学中的应用 叶邦角 中国科学技术大学理学院 PDF文件使用"pdfFactory”试用版本创建f3 fineprint.cn
正电子在材料科学中的应用 叶邦角 中国科学技术大学理学院 PDF 文件使用 "pdfFactory" 试用版本创建 3www.fineprint.cn ÿf3

第一讲 正电子概况(① 山正电子发现 口正电子的特性 口正电子产生和正电子源 口正电子偶素 PDF文件使用"pdfFactory”试用版本创建ww.fineprint.cn
正电子概况(I) 第一讲 正电子发现 正电子的特性 正电子产生和正电子源 正电子偶素 PDF 文件使用 "pdfFactory" 试用版本创建 ÿwww.fineprint.cn

一、正电子发现 1897年J.J.Thomson 发现电子 1913年E.Rutherford粒子散射 1919年E.Rutherford质子,F.Hess气球实验(宇宙线 1932年Chadwick发现了中子 1931-33年Pauly,Fermi>对原子核的B衰变谱的解释: 中微子(⑤6年实验证实) 1932年Anderson发现反电子(e) 1935年H.Yukawa预言存在π介子,M~1/7M. 1936年Anderson在宇宙线中发现“介子”(u-轻子) PDF文件使用"pdfFactory”试用版本创建ww.fineprint..cn
一、正电子发现 1897年J.J.Thomson 发现电子 1913年E.Rutherford a 粒子散射 1919年E.Rutherford 质子, F.Hess 气球实验 (宇宙线) 1932年Chadwick发现了中子 1931-33年Pauly,Fermi对原子核的 b 衰变谱的解释: 中微子(56年实验证实) 1932年Anderson发现反电子(e+ ) 1935年H.Yukawa 预言存在p介子,Mp~1/7 Mp 1936年Anderson 在宇宙线中发现“介子”( m-轻子) PDF 文件使用 "pdfFactory" 试用版本创建 ÿwww.fineprint.cn
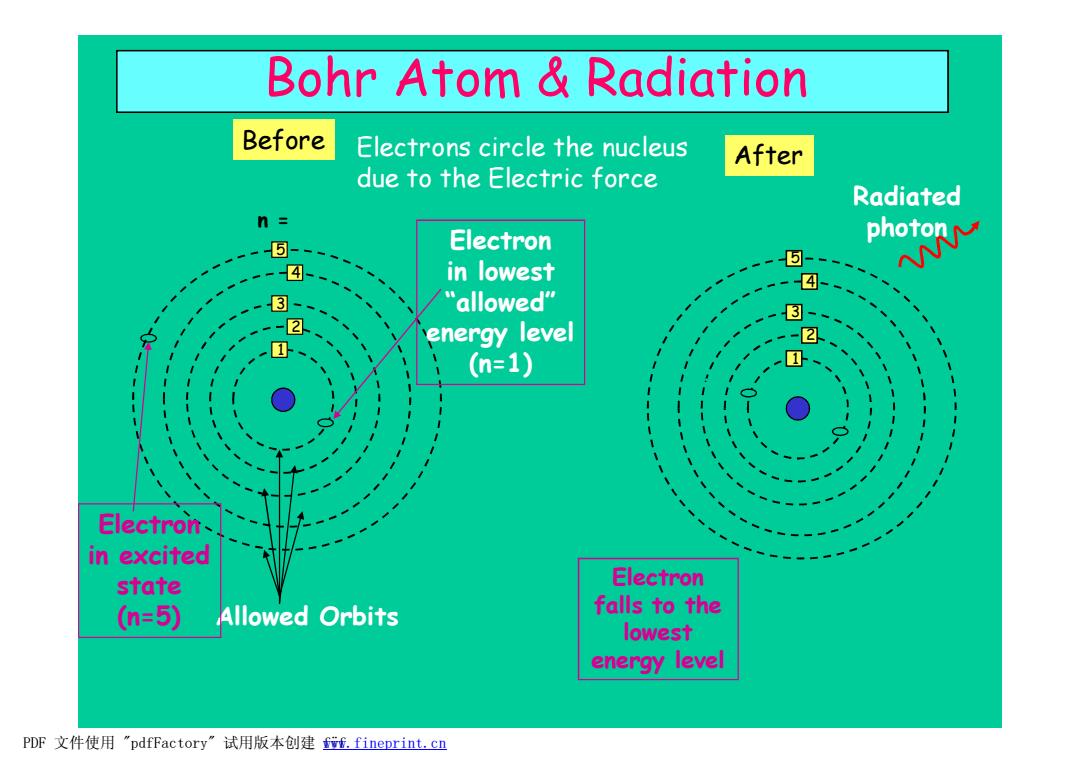
Bohr Atom Radiation Before Electrons circle the nucleus After due to the Electric force Radiated n= ⑤- Electron in lowest ph米 -④ 3- "allowed" 3- energy level (n=1) Electron- in excited state Electron (n=5) Allowed Orbits falls to the lowest energy level PDF文件使用"pdfFactory”试用版本创建ff.fineprint.cn
Electrons circle the nucleus due to the Electric force Bohr Atom & Radiation Allowed Orbits 1 2 3 4 5 n = Electron in lowest “ allowed” energy level (n=1) Electron in excited state (n=5) Before 1 2 3 4 5 Electron falls to the lowest energy level After Radiated photon PDF 文件使用 "pdfFactory" 试用版本创建 f www.fineprint.cn ÿf

Atomic Radiation It is now "known"that when an electron is in an excited state",it spontaneously decays to a ower-energy stable state. The difference in energy,AE,is given by: E5>E4>E3>E2>E One example could be: AE E5-E1=hv=Ephoton Energy Electron Energy Electron h=Planck's constant=6.6x10-34 [J s] in excited in lowest v=frequency of light [hz] state state (higher PE) (lower PE) The energy of the light is DIRECTLY PROPORTIONAL to the frequency,v. n=5 n=5 n=4 E4 Recall that the frequency,v,is related to n=4 the wavelength by: n=3 n=3 c=V入 (V=c/) n=2 E2 n=2 E, So,higher frequency higher energy n=1 n-1 →lower wavelength Before After This is why UV radiation browns your skin but visible light does not PDF文件使用"pdfFactory'”试用版本创建w,fineprint.cn
Atomic Radiation The difference in energy, DE, is given by: DE = E5 – E1 = hn = Ephoton h = Planck’s constant = 6.6x10-34 [J s] n = frequency of light [hz] The energy of the light is DIRECTLY PROPORTIONAL to the frequency, n. Recall that the frequency, n, is related to the wavelength by: c = n l (n = c / l) So, higher frequency è higher energy è lower wavelength This is why UV radiation browns your skin but visible light does not ! It is now “known” that when an electron is in an “ excited state” ,it spontaneously decays to a lower-energy stable state. Before n = 1 n = 2 n = 3 n = 4 n = 5 Energy Electron in excited state (higher PE) E5 E4 E2 E3 E1 E5 > E4 > E3 > E2 > E1 After n = 1 n = 2 n = 3 n = 4 n = 5 Energy Electron in lowest state (lower PE) E5 E4 E2 E3 E1 One example could be: PDF 文件使用 "pdfFactory" 试用版本创建 ÿÿwww.fineprint.cn