
化学反应的方向、速率和限度 焓判据:等温、等压条件下: △Hm<0 化学反应自发进行 △Hm>0化学反应不能自发进行 最低能量原理是许多实验事实的总 结,对多数放热反应是适用的。 但有些吸热反应也能自发地进行。 2009-6-2 11
2009-6-2 11 化学反应的方向、速率和限度 焓判据:等温、等压条件下: rHm<0 化学反应自发进行 rHm>0 化学反应不能自发进行 最低能量原理是许多实验事实的总 结,对多数放热反应是适用的。 但有些吸热反应也能自发地进行

化学反应的方向、速率和限度 有些吸热反应也是能自发进行的: NHCI(s)→NH4+(aq)+C(aq)AHm=9.76kJ·mo1 CaC03s)△Ca0(s)+C02(g)4Hm=178.32kJ·molr H,0① 100°CH,0(g) 4Hm=44.0kJ·mol 结论:焓变只是影响反应自发性的因素 之一,但不是唯一的影响因素。 2009-6-2 12
2009-6-2 12 化学反应的方向、速率和限度 有些吸热反应也是能自发进行的: NH4Cl (s) →NH4 + (aq)+Cl- (aq) CaCO3 (s) CaO(s)+CO2 (g) H2O(l) H2O(g) -1 ΔrHm 9.76kJmol -1 ΔrHm 178.32kJ mol -1 ΔrHm 44.0kJ mol 100C 结论:焓变只是影响反应自发性的因素 之一,但不是唯一的影响因素

化学反应的方向、速率和限度 2.化学反应的熵变 实践和研究表明,许多自发过程还会 导致系统的混乱度增加。 例如:理想气体的扩散。在扩散的自发 过程中,系统的温度、压力都无变化, 不同的只是系统比先前更无秩序、亦即 混乱度增加了。换言之,这一过程是自 发地趋向于混乱度大的状态。 2009-6-2 13
2009-6-2 13 化学反应的方向、速率和限度 2. 化学反应的熵变 实践和研究表明,许多自发过程还会 导致系统的混乱度增加。 例如:理想气体的扩散。在扩散的自发 过程中,系统的温度、压力都无变化, 不同的只是系统比先前更无秩序、亦即 混乱度增加了。换言之,这一过程是自 发地趋向于混乱度大的状态
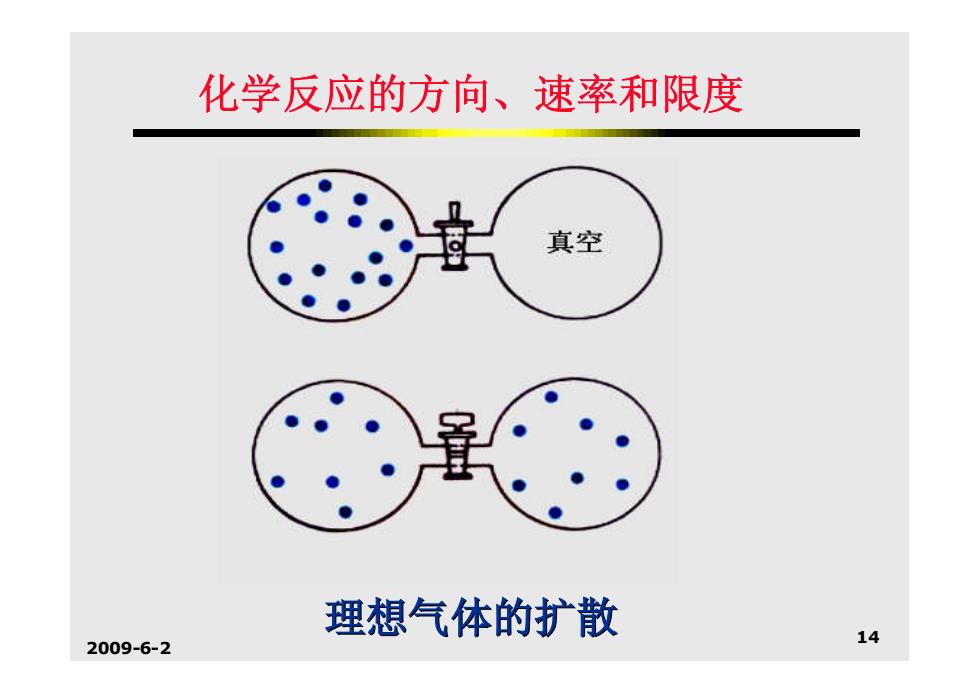
化学反应的方向、速率和限度 真空 理想气体的扩散 2009-6-2 14
2009-6-2 14 化学反应的方向、速率和限度 理想气体的扩散

化学反应的方向、速率和限度 表明混乱度增加的第二个例子: ■是NH,NO3的溶解,这在一定温度下 也是一自发过程。 固体的NH4NO3在水中先离解出 NH4+和NO3,继而向水中扩散, 直至形成均匀溶液。 2009-6-2 15
2009-6-2 15 化学反应的方向、速率和限度 表明混乱度增加的第二个例子: 是NH4NO3的溶解,这在一定温度下 也是一自发过程。 固体的NH4NO3在水中先离解出 NH4 + 和 NO3 - ,继而向水中扩散, 直至形成均匀溶液